
题目列表(包括答案和解析)
27、(10分)分子筛是一类具有多孔性的铝硅酸钠盐。分子筛晶体中的骨架是由SiO4四面体和AlO4四面体通过顶角的氧原子连接而成的,经测定硅铝比(SiO2-Al2O3的物质的量之比)为6:3,AlO4四面体带一个单位负电荷。SiO4可表示为:
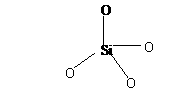
(1)写出Al原子的电子排布式
(2)该分子筛的化学式为
(3)在SiO4四面体,硅、氧原子个数比为 (1分),硅、氧之间的成键方式为
(4)O、Si、Al三种元素的单质晶体中,熔、沸点最高的是
(5)该分子筛能把空气中的O2和N2分离提纯得到O2,原理是
26.(10分).由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均
已省略):
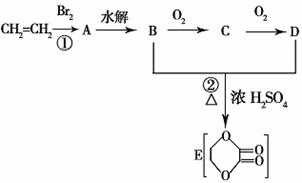
请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X的结
构简式为_________________,X的名称为_______________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,
试写出B、D反应生成该高分子化合物的方程式_________________________。
元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是 ,写出D离子的电子排布式 。
⑵D和C形成的化合物属于 晶体。
写出C单质与水反应的化学方程式 。
⑶对元素B的单质或化合物描述正确的是 。
a. B元素的最高正价为+6
b. 常温、常压下单质难溶于水
c. 单质分子中含有18个电子
d. 在一定条件下镁条能与单质B反应
⑷A和D两元素金属性较强的是(写元素符号) 。写出能证明该结论的一个实验事实 。
24.(11分)
铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱式碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
23、(10分)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
N2O4  2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s)n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A. 增大N2O4的起始浓度
B. 向混合气体中通入NO2
C. 使用高效催化剂
D. 升高温度
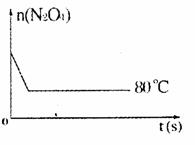
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
22. (12分)工业制硫酸生产流程如下图:
|
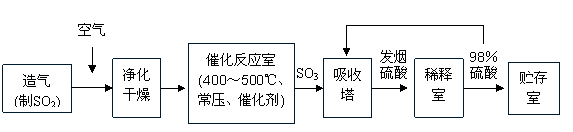

(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率采取了哪些措施?
A、净化气体 B、控制温度在400-500℃
C、增大催化剂与反应气体的接触面积 D、不断补充空气
(3)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(5)生产硫酸过程中的尾气通常用氨水吸收,请写出该反应的化学反应方程式 、 。
21、(15分)
Ⅰ(2分)下列说法中,正确的有
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过三分之一的试管加热至沸腾
③硝酸、溴水可长期盛放在棕色的滴瓶中
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤熔融氢氧化钠要在耐高温的石英坩埚中
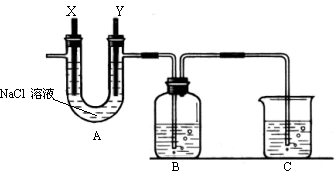
Ⅱ(13分)某化学兴趣小组利用细废铁屑制取FeCl3•6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
② 按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
请回答下列问题:
(1)A中的X极应连接电源的 极,A中发生化学反应的方程 式 ;B中溶液颜色的变化 ,
反应的离子方程式是 。
(2)C烧杯中应该盛放的是 ,其作用是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3•6H2O晶体,④需要进行的操作依次是(填序
号) 。
A、加热浓缩 B、洗涤 C、过滤 D、冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是 。
20、(14分)下图表示各物质之间的相互转化关系(部分反应物或生成物未列出)。其中A、D
为常见金属,J为红褐色沉淀。

(1)A的原子结构示意图为_____________,B的化学式为_______________。
(2)反应②的离子方程式________________________________________,反应⑥的化学
方程式___________________________________________________________。
(3)在反应③中,要使E中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物
是_______________;若将E溶于过量盐酸,反应的离子方程式为___________________。
(4)在实验室进行反应⑧时,观察到的现象是__________________________________,
在所得产物中加入水,得浑浊液,要使其变澄清,可加入少量的_____________________。
19、(7分)在密闭容器中,可逆反应CO(g)+NO2(g)  CO2(g)+NO(g)(正反应为放热反
CO2(g)+NO(g)(正反应为放热反
应)达到平衡,其它条件不变时,若
(1)扩大容器体积,平衡______移动,c(NO2)将_________,反应混合物的颜色_________。
(2)升高温度,平衡_____________移动,体系的压强__________________。
(3)加入催化剂,NO的物质的量如何变化?___________,原因是________________。
18、下列实验操作完全正确的是
|
编号 |
实验 |
操作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
第Ⅱ卷 非选择题(共87分)
三。(包括4小题,共36分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com