
题目列表(包括答案和解析)
2.下列叙述正确的是
A.构成分子晶体的粒子中一定含有共价键 B.在离子晶体中不可能存在非极性键
C.离子化合物中可能含有共价键 D.在原子晶体中不可能存在极性共价键
1. 下列说法正确的是
A.日常生活中常用无水乙醇杀菌消毒 B.绿色食品是不含任何化学物质的食品
C.为保证饮食卫生大力提倡使用一次性筷子 D.燃煤时加入适量的石灰石,可减少废气中的二氧化硫
28. (9分) 在标准状况下进行甲、乙、丙三组实验,三组各取30 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,反应产生气体,有关数据列表如下,请分析并回答下列问题:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(mg) |
255 |
385 |
459 |
|
生成气体体积(mL) |
280 |
336 |
336 |
(1)乙组实验中,盐酸_____________(填:“过量”,“适量”或“不足量”).所用盐酸的物质的量浓度为_________________.
(2)求合金中Mg、Al的物质的量之比为_________.
(3)在丙组实验之后,向容器中加入1 mol/L氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使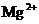 刚好沉淀完全,再过滤出不溶固体,求所加入的氢氧化钠溶液的体积(写计算过程)
刚好沉淀完全,再过滤出不溶固体,求所加入的氢氧化钠溶液的体积(写计算过程)
杭州儒林·育英高复学校第一次段考化学试卷
27.(6分) 标准状况下336L的NH3溶于1L水中,则所得溶液的溶质质量分数为 ,若该溶液的密度为a g/mL,则其物质的量浓度为 (用含a的式子表示),将上述氨水全部转化为NH4Cl,需要4mol/L的盐酸的体积是 。
26.(15分)有一白色固体混合物,可能含有的阴、阳离子分别是:
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
|
阴离子 |
SO42- SO32- CO32- AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
|
排除的离子 |
排除的依据 |
|
|
|
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
|
肯定存在的离子 |
判断依据 |
|
|
|
|
排除的离子 |
排除的依据 |
|
|
|
(3)尚待检验的离子及其检验方法
|
尚待检验的离子 |
检验方法 |
|
|
|
25.(8分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) 。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或 ,反应①的离子方程式为 或 。
24.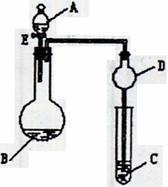 (10分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(10分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 。
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的离子反应方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为 。
(5)该题图示装置有多种用途,请举一例(除题中之外)填空:A ,B为 ;C中盛 ,其目的为 。
23.(8分)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。

(2)反应中,被还原的元素是_______,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
22.工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充
水,也无多余的水分,所用硫酸溶液溶质的质量分数应为。
A.45.8% B.57.6% C.72.3% D.无法确定
卷Ⅱ 非选择题(共56分)
21.金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:
2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是 ( )
A.O2只做氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1mol O2参加反应,则反应中人有4mol电子转多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com