
题目列表(包括答案和解析)
22.(6分)下图为喷泉实验装置图。
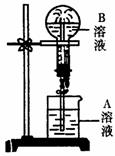
(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质的名称或化学式。
|
编号 |
A溶液颜色 |
B溶液颜色 |
A溶液中溶质 |
|
① |
无色 |
红色 |
1分 |
|
② |
黄色 |
红褐色浑浊 |
1分 |
|
③ |
橙色 |
黄色 |
1分 |
|
④ |
无色 |
白色胶状沉淀 |
1分 |
(2)若大烧瓶内充的是不易形成喷泉的含氧72.7%的XO2气体,但如果加入固体YOH 再作轻轻振荡后,则可形成喷泉。实验后取烧瓶内溶液作焰色反应,其焰色为浅紫色,则XO2的化学式为____2分 ____。
21.(1)113 ~ 450℃,-2、+4、+6;(2)H2Te>H2Se>H2S;(3)2H2Se + O2 == 2H2O + 2Se
(4)①H2O2、H2S的电子式②稳定性越大,△H越小③H2Se(g)=H2(g)+Se(s) △H= - 81KJ/ mol
21.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表格回答下列问题:
(1)硒的熔点范围可能是 1分 碲的化合价可能有 1分
(2)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 2分 (填化学式)
 (3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为______________2分 ___________________。
(3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为______________2分 ___________________。
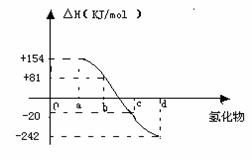
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物放出或吸收的热量叫该化合物的生成热。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。请回答下列问题:
①写出氧族元素中含18电子的两种氢化物的电子式__2分 __________
②请你归纳:非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系________________________
③写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_____2分 _____________________
20. ⑴①接触室 ②点燃 ③4FeS2+11O2 2Fe2O3+8SO2; ⑵ ①Na+[
2Fe2O3+8SO2; ⑵ ①Na+[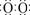 ]2-Na+ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
]2-Na+ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
20.(10分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
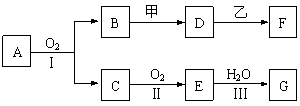
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在______1分_________中进行。
②工业上制备甲的反应条件是___1分________。
③反应Ⅰ的化学方程式是______________2分______________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是___2分_________。
②D的溶液与乙反应的离子方程式是______________2分____________________。
③若1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________2分_______________________________。
19.(8分)在化工生产中,要用到一种无色、可溶于水的晶体:铝铵矾。该晶体是一种复盐,其主要成分是十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。
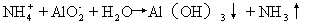
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为___2分 ___;
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气味的气体产生;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少。
请答出各种现象由先到后出现的顺序(用序号回答)____→____→____→____→____;2分
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:②__2分 __________;⑤_____________2分_____。
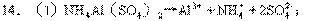
(2)①→③→②→⑤→④;
(3)①Al3++3OH-→Al(OH)3↓②NH4++OH-→NH3↑+H2O
⑤Al(OH)3+OH-→AlO2-+2H2O
18.(12分)某化学课外兴趣小组在做铜与浓硝酸、稀硝酸反应实验时发现:“相同质量的铜分别与等体积且足量的浓硝酸、稀硝酸充分反应后,前者溶液颜色是绿色的,后者溶液的颜色是蓝色的。”
⑴一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)____不同意__(1分)_________,原因是___因为铜片质量相同,溶液体积相同,生成的铜离子浓度相同_____(2分)____________
⑵另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确,甲、乙、丙三位同学分别设计了三种方案进行验证:
甲同学方案:将盛绿色溶液的试管加热,看是否有红棕色气体产生
① 你认为甲同学的方案是否妥当?为什么?___不妥当,硝酸是过量的,即使溶液里没有二氧化氮,加热过程中因为硝酸的分解也会产生二氧化氮_,应当通过观察其溶液是否变蓝色来加以验证_______(2分)__________。
② 乙同学方案:用双氧水和二氧化锰制得氧气,并把氧气通入绿色溶液中,观察其溶液是否变蓝色。
②请用方程式表示其中的反应原理________________________________
丙同学方案:在通风橱内,将一根下端弯成螺旋状且可抽动的铜丝插在盛有足量浓硝酸的试管甲中,立即可观察到试管中充满红棕色的NO2气体。将气体经导管通入到倾斜的另一支盛有淡蓝色Cu(NO3)2试管乙中,随着实验进行,试管乙中的溶液蓝色加深,很快又变成绿色,继续通入NO2,绿色保持不变,向上抽起铜丝,使反应停止。
③ 写出铜与浓硝酸反应的离子方程式____Cu+4H++2NO3-=Cu2+(2分) +2NO2+2H20
_________________________
④从环保的角度看,你认为三个方案中最好的是哪一个,_乙____(1分)______其原因是__因为乙方案中没有有毒气体产生______(2分)__________
17.(10分)请按要求填空:
⑴下列实验方案不合理的是______6分,每项2分,错选一个抵消一个正确答案_________
A、配制50克质量分数为5%NaCl溶液:将47.5mL水加入到盛有2.5克NaCl的烧杯中,搅拌溶解
B、鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液
C、鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
D、检验碳酸钠溶液中是否混有氢氧化钠:可向其中滴入酚酞试液,若溶液变红,则说明有氢氧化钠
E、向氯化铁溶液中滴加氢氧化钠溶液不断振荡,即制得氢氧化铁胶体,并可用过滤法除去氢氧化铁胶体中少量的氯化铁
F、用四氯化碳作萃取剂来萃取碘水中的碘单质
⑵碱式氯化铜 (Cupric Chloride,不溶于水的绿色结晶)是一种农药,
分子式:CuCl2·3Cu(OH)2·XH2 O(X=1/2,1,2)为确定X值,请你设计一个合理的实验方案:
|
实验步骤(简明扼要,但必须把所用的试剂和仪器名称讲清楚) |
实验过程中所发生反应的化学方程式 |
实验需直接测定的有关物理量(用文字说明) |
|
|
|
|
每格2分,计6分
16.(此题物化班做)密闭容器中,300℃时将100mL由H2O、CO2、H2和CO组成的混合气体与足量的Na2O2在连续电火花作用下充分反应后,容器内压强只有原来的五分之一,则原混合气体中各组分的体积比不可能是
A.1∶1∶1∶1 B.3∶1∶2∶4 C.1∶3∶5∶1 D.2∶2∶3∶3
(此题生化班做)某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A.11.2克 B.16.8克 C.19.6克 D.22.4克
15. 氯酸(HClO3)是一种强氧化性酸。若将铜粉投入氯酸溶液中,下列物质一定不可能的是
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com