
题目列表(包括答案和解析)
4.X、Y两种元素形成含氧酸A和B,能说明酸A比酸B的酸性强的是
A.酸A中X的化合价比酸B中Y化合价高
B.酸A中X与酸B中Y在同一周期,且X在Y之后
C.酸A能与酸B的铵盐溶液反应生成酸B
D.酸A具有强氧化性,酸B没有强氧化性
3.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A.NH3 + HCl = NH4Cl B.NaOH + HCl = NaCl + H2O
C.Mg +2HCl = MgCl2 + H2↑
D.H2O
+CH3COOH 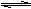 H3O+ +CH3COO -
H3O+ +CH3COO -
2.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
1.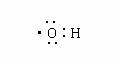
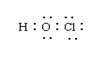 下列化学用语表示错误的是
下列化学用语表示错误的是
A.次氯酸电子式 B.羟基电子式


C.镁离子结构示意图 D.氨分子空间结构
25.(12分)当一定质量的铜粉加入到盛有200 mL某浓度的稀硝酸的容器中充分反应。
⑴当容器中剩有m1克的铜粉时,收集到标准状况下448mL的NO气体。
① 所得溶液中溶质的化学式是___ Cu(NO3)2____2分
② 原硝酸的物质的量浓度为____0.4______mol/L 2分
⑵向⑴所得固液混合物中逐滴加入稀硫酸至刚好不再产生气体为止,该气体遇空气变红棕色,此时容器中有铜粉m2克
① 此时溶液中增加的溶质的化学式是__ _CuSO4________2分
② 写出加入稀硫酸后所发生的离子反应方程式___ 3Cu+8H++2NO3-=3Cu2+ +2NO+4H20 2分
③ m1-m2=_____5.76g__ 4分
24.(6分)向0.5升AlCl3和FeCl3混合溶液中加入a mol NaOH溶液时,产生的沉淀量可达到最大值;继续加入 NaOH溶液,沉淀开始溶解,当前后加入的 NaOH总量达到b mol 时,沉淀不再减少,求原溶液中Fe3+的物质的量浓度。
(8a-6b)/3
23.(10分)(此题生化班做)氰化钾、氰化氢的制备反应式为:
K2CO3+C+2NH3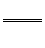 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3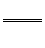 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
⑴氰离子为负一价(CN-),其中碳氮元素的化合价分别为__2分 ______。 以上两个反应是否均为氧化还原反应? 2分
⑵制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热
①试写出这个反应式。 2分 ②为什么要磨细和用粉末? 2分
③为什么要强调适度加热? 2分
[解析] 据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS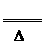 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS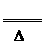 HCN↑+K2S。
HCN↑+K2S。
23. (1) Cl,
NH3+ HCl = NH4Cl (2) NH4++H2O NH3·H2O
(1) Cl,
NH3+ HCl = NH4Cl (2) NH4++H2O NH3·H2O
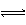 (3) ①
BiCl3+H2O BiOCl+2HCl ②盐酸抑制BiCl3水解,BiOCl中的Cl为-1价
(3) ①
BiCl3+H2O BiOCl+2HCl ②盐酸抑制BiCl3水解,BiOCl中的Cl为-1价
23.(10分)(此题物化班做) A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10。B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18。A、B、D能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)C的元素符号 1分 ,X跟Y反应的化学方程式 2分 。
(2)用离子方程式解释A、B、D形成的化合物水溶液呈弱酸性的原因是 2分 。
(3)铋(Bi)跟C元素能形成化合物(BiC3),其水解生成难溶于水的(BiOC)。
① BiC3水解反应的化学方程式为 2分 。
②把适量的BiC3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。 2分
③医药上把BiOC叫做“次某酸铋”,分析这种叫法的不合理之处。 1分
13.(1)①酚酞 ②FeCl3 ③甲基橙 ④AlCl3 (2)CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com