
题目列表(包括答案和解析)
24.(10分)在 763 K 3.04×104 kPa
时,用CO和H2为原料合成CH3OH,存在下列平衡:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
|
m |
α |
y |
|
1 |
0.25 |
|
|
2 |
0.45 |
|
|
3 |
|
19.35% |
⑴设H2和CO的起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,试推断m、α、y三者的相互关系,并以y=f (α,m)的函数表达式表示出来:
____________________________________________。
⑵将右表已知数据代入你导出的表达式中进行计算,把计算结果(保留至小数点后两位)填入右表中有关空格栏中:
⑶根据上表数据,判断用CO和H2合成甲醇时,H2和CO的最佳体积比是 。
23.(10分)在化学反应中,只有极少数
能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子称
为活化分子,使普通分子变成活化分子所
需提供的最低限度的能量叫活化能,其单
位通常用kJ/mol表示。请认真观察右图,
然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=___________________kJ/mol(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:___________________________。
22.(14分)有a、b 两个极易导热的密闭容器,a 保持容积不变,b 中的活塞可上下移动,以保持恒压。在相同条件下将3
mol A、1
mol B 分别同时混合于a、b 两容器中,发生反应:
3A(g)+B(g)  2C(g)+D(g)
2C(g)+D(g)
⑴达到平衡时,a 中A的浓度为 M mol·L-1,C 的浓度为 N mol·L-1;b 中 A 的浓度为m mol·L-1,C 的浓度为 n mol·L-1。则 M m;N n(填“>”或“<”或“=”)。
⑵保持温度不变,若按下列配比分别充入 a、b 两容器,达到平衡后,使 a 中 C 的浓度为 N mol·L-1的是 ;使 b 中 C 的浓度为 n mol·L-1的是 。
A.6 mol A+2 mol B B.3 mol A+2 mol C C.2 mol C+1 mol B+1 mol D
D.2 mol C+1 mol D E.1.5 mol A+0.5 mol B+1 mol C+0.5 mol D
⑶若将2 mol C和2 mol D充入 a 中,保持温度不变,平衡时A的浓度为 W mol·L-1,C 的浓度为Y mol·L-1,则 W 和M,Y 和 N 之间的关系为W M,Y N(填“>”或“<”或“=”)。
⑷保持温度不变,若将4 mol C和2 mol D充入a中,平衡时A的浓度为R mol·L-1,则 。
A.R=2M B.R<M C.M<R<2M D.R>2M
21.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g)
+ B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________________________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
⑶某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
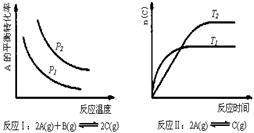
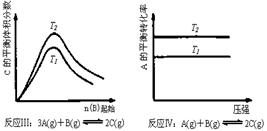
根据以上规律判断,下列结论正确的是(选项中的△H表示正反应的反应热)
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
高三化学第三次考试
第II卷(共70分)
19.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
18.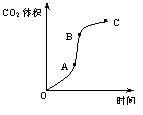 某学生用优质大理石与稀盐酸反应制取CO2,实验结果表示如下图,对于图中曲线的叙述中正确的是
某学生用优质大理石与稀盐酸反应制取CO2,实验结果表示如下图,对于图中曲线的叙述中正确的是
A.AB段表示反应速率最快,因产物中的CaCl2可能有催化作用,且反应为放热反应
B.BC段表示反应速率最快,在该时间内收集到的气体最多
C.OC段表示随时间增加,反应速率逐渐增大
D.OC段表示反应产物中气体体积随时间的变化关系
17.某温度下,在一容积可变的密闭容器里,反应2A(g)
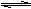 B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将向正反应方向移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加
16.对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
15.下列离子反应方程式正确的是
A.硫代硫酸钠溶液加入硫酸溶液中:S2O32-+2H+ = S↓+SO2↑+H2O
B.二氧化硫气体通入过量Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO
C.在碳酸氢钠溶液中加入足量澄清石灰水:
2HCO3-+Ca2+ +2OH- = CO32-+CaCO3↓+2H2O
D.KHS的水解:HS-+H2O  H3O+ + S2-
H3O+ + S2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com