
题目列表(包括答案和解析)
分子缔合作用,是由于分子间氢键的形成,钳环化则是由于分子内氢键的形成。两者对于化合物的性质的影响是显著的,并且往往是相反的,现简述如下。
(1)对沸点和熔点的影响:分子间氢键的形成使物质的沸点和熔点升高,因为要使液体气化,必须破坏大部分分子间的氢键,这需要较多的能量;要使晶体熔化,也要破坏一部分分子间的氢键。所以,形成分子间氢键的化合物的沸点和熔点都比没有氢键的同类化合物为高。
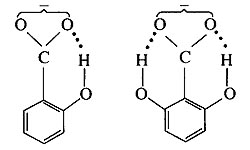
分子内氢键的生成使物质的沸点和熔点降低,如邻位硝基苯酚的熔点为45 ℃,而间位和对位硝基苯酚的熔点分别是96 ℃和114 ℃。这是由于间位和对位硝基苯酚中存在着分子间氢键,熔化时必须破坏其中的一部分氢键,所以它们熔点较高;但邻位硝基苯酚中已经构
成内氢键,不能再构成分子间氢键了,所以熔点较低。
(2)对溶解度的影响:在极性溶剂里,如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。如果溶质分子钳环化,则在极性溶剂里的溶解度减小。例如,对硝基苯酚中O-H基,能同水的氧原子缔合成氢键,促使它在水中溶解,因此溶解度大,在水蒸气里不挥发。但邻硝基苯酚的O-H基,通过氢原子能与其邻位上硝基的氧原子钳环化,即不能再同水的氢原子形成氢键,因此溶解度减小,而且易被水蒸气蒸馏出去。邻位与对位硝基苯酚在20 ℃的水里的溶解度之比为0.39。钳环化的化合物在非极性溶剂里,其溶解度与上述情况相反。
(3)对酸性的影响:如苯甲酸的电离常数为K,则在邻位、间位、对位上带有羟基时,电离常数依次为15.9 K、1.26K和0.44 K。如左右两边邻位上各取代一羟基,则电离常数为800 K。这是由于邻位上的羟基与苯甲酸根生成带氢键的稳定的阴离子,从而增加了羧基中氢原子的电离
典例剖析
[例1]下列说法中正确的是 A、离子键是阴阳离子间存在的静电引力 B、失电子难的原子获得电子的能力一定强 C、在化学反应中,某元素由化合态态变为游离态,该元素被还原。 D、电子层结构相同的不同离子,其半径随核电荷数增多而减少。 解析:A错。静电作用包括引力和斥力两方面的作用。B:失电子难的原子,获得电子的能力不一定强,例如稀有气体,失电子难,得电子也难。C:化学反应中,元素的化合态变为游离态,可能被氧化,也可能被还原。如: CuCl2+Fe→FeCl2+Cu, 则Cu2+被还原;CuBr2+Cl2→CuCl2+Br2 则Br-被氧化D是对的,答案为D。 [例2]下列叙述正确的是 A、两种非金属原子间不可能形成离子键。B、非金属原子间不可能形成离子化合物。 C、离子化合物中可能有共价键。 D、共价化合物中可能有离子键。 解析:两种非金属原子间不能得失电子,不能形成离子键,A对,非金属原子,当组成原子团时,可以形成离子的化合物,如NH4Cl, B错;离子化合物中可以有共价键,如:NaOH中的O-H键,C对;有离子键就是离子化合物,D错。答案为A、C。 [例3] 以下叙述中错误的是
A. 钠原子与氯气反应生成食盐后,其结构的稳定性增强
B. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用
C. 任何离子键在形成过程中必定有电子的得与失
D. 钠与氧气反应生成氧化钠后,体系的能量降低
解析:钠原子最外层只有一个电子,当它失去1个电子后可以形成8个电子的稳定结构使体系的能量降低,所以A、D项均正确;在离子化合物中除阴阳离子电荷之间的静电引力外,还存在电子与电子,原子核与原子核之间的排斥作用,所以B项正确;一般说来形成离子键有电子的得失,但也有例外如铵盐的形成。答案:C。
[例4]有A、B、C、D四种元素。已知:A的最高正价与其最低负价的代数和为6,A、D次外层电子都是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴,阳离子,B有两个电子层,其最高正价与最低负价的代数和为零;C2-离子与氪原子具有相同的电子层结构。试写出: (1)上述各元素的符号:A_____B_____C_____D_____。 (2)DA的电子式为________。 解析:最高正价与负价代数和为6的元素位于第ⅦA族(+7,-1)。最高正价与负价代数和为4的元素位于第ⅥA族(+6,-2)。第ⅤA族的最高正价与负价的代数和为2(+5,-3)。第ⅣA族元素的最高正价与负价的代数和为零(+4,-4)。所以A位于ⅦA,B位于ⅣA,B有两个电子层,B为碳元素。C2-离子与氪原子具有相同的电子层结构,所以C为ⅥA族并位于第四周期,即为Se元素。A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,且A、D次外层都有8个电子,所以A为氯元素,D为钾元素。答案:(1)Cl、C、Se、K。
知能训练
3、特征不同:离子键无饱和性和方向性;共价键有方向性和饱和性。
2、作用方式不同:离子键是通过阴阳离子间的静电作用形成;共价键是通过共用电子对的作用形成。
1、形成条件不同:离子键只有在易失电子的活泼金属元素(ⅠA、ⅡA)的原子与易获得电子的活泼非金属(卤素、氧、硫等)的原子间形成;共价键主要存在于同种非金属元素、不同种非金属元素或金属性较弱的金属元素与非金属性较弱的非金属元素的原子间。
元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。离子键没有方向性和饱和性。由离子键形成的化合物称离子化合物。在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。共价键是靠共用电子对形成的化学键,具有方向性和饱和性。分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。形成极性键时,有如下两种情况:
化学键的极性是分子极性产生的原因之一。当分子中所有化学键都是非极性键时,分子为非极性分子。当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
现列举说明如下:
|
键的极性 |
代表物 |
分子空间构型对称性 |
分子的极性 |
|
非极性键 |
N2、CI2、O2 |
直线型;对称 |
非极性分子 |
|
极性键 |
HCI、 HBr |
直线型、不对称 |
极性分子 |
|
CO2、CS2 |
直线型;对称 |
非极性分子 |
|
|
H2O、H2S |
折线型、不对称 |
极性分子 |
|
|
BF3 |
平面三角型、对称 |
非极性分子 |
|
|
NH3 |
三角锥型、不对称 |
极性分子 |
|
|
CH4、CCI4 |
正四面体;对称 |
非极性分子 |
3.分子间作用力 :分子间作用力存在于:________之间。 化学键存在于:________原子之间。氢键是一种分子间作用力,影响物质的____,如H2O由于分子间氢键的形成,分子间作用力骤然增强,从而改变了Te-S氢化物熔沸点降低的趋势而猛然升高,卤族中的HF和氮族中的NH3也有类似情况。
疑难点拨
2、极性分子:分子中由于电子云分布不均匀而呈极性的分子。由极性键结合形成的分子,正、负电荷重心不重叠,产生正、负极,分子结构不对称,属于分子极性分子。如:HCl、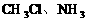 。
。
1、非极性分子:分子中电子云分布均匀,分子结构对称的分子属于非极性分子。只由________分子。如: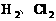 。由________也属于非极性分子。如:
。由________也属于非极性分子。如: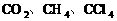
(1)键长:__________________核间距离。
键长决定分子的稳定性,一般说来,键长越___,键越___,也越稳定。键长的大小与成键微粒的半径大小有关。如键和H-Cl_H-Br_H-I,则稳定性:H-Cl_H-Br_H-I。
(2)键能:拆开1 mol某键所需的能量叫键能。单位:_____。键能决定分子的稳定性,键能越_,键越_,分子越_。
(3)键角:________的夹角。
键角决定分子的空间构型,凡键角为180°的为_____,如: ;凡键角为109°28′的为_____体,如:
;凡键角为109°28′的为_____体,如: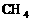 。
。
4.化学键:使离子相结合或原子相结合的作用。
注意:①化学键存在分子内②化学键是一种较强的相互作用
He、Ar、Ne、等稀有气体分子中是否存在化学键?______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com