
题目列表(包括答案和解析)
18、(8分) 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
17、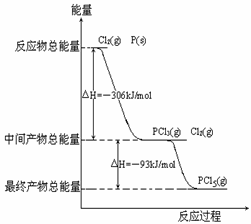 (12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据右图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
(2)PCl5分解成PCl3和Cl2的热化学方程式 ,
上述分解反应是一个可逆反应,温度T1时,在密闭容器中
加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其
分解率α1等于 ;若反应温度由T1升高到T2,平衡
时PCl5的分解率为α2,α2 α1(填“大于”、“小于”
或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成
中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4___△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式_________________________。
16、(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],
然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度(/mL) |
滴定后刻度(/mL) |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
15、(10分)常温下,在经过砂纸打磨的铝片上取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸的两支试管(容积相同)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
①写出以上反应的离子方程式________________________________________________
②你认为出现以上现象的可能原因是:假设a____________;假设b____________。
③请设计实验对以上的假设进行验证_________________________________________
④如果上述假设成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:(至少写四种)_______________________________________________________________。
14、常温下,0.1mol.L-1某一元酸(HA)的pH>1,在0.1mol.L-1某一元碱(BOH)中H+和OH-离子物质的量浓度的关系为:c(H+) / c(OH-)=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系正确的是
A、c(B+)>c(A-)>c(OH-)>c(H+) B、c(A-)>c(B+)>c(H+)>c(OH-)
C、c(B+)+ c(H+) = c(OH-)+ c(A-) D、c(B+)>c(A-)>c(H+)>c(OH-)
第Ⅱ卷(非选择题,共72分)
13、温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡
A(g)+ B(g)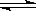 3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增
大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增
大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
A、C为非气态 B、C为气态
C、第二次达到平衡时C为气态 D、第三次达到平衡时C为非气态
12、据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
A、正极反应式为:O2+2H2O+4e-=4OH―
B、工作一段时间后,电解液中KOH的物质的量不变
C、该燃料电池的总反应方程式为:2H2+O2=2H2O
D、用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
11、对于平衡体系:mA(g)+nB(g) pC(g)+qD(g)+Q有下列判断,其中正确的是
pC(g)+qD(g)+Q有下列判断,其中正确的是
A、若温度不变,将容器的容积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
B、若平衡时,A.B的转化率相等,说明反应开始时,A.B的物质的量之比为m∶n
C、若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于a+b,则m+n=p+q
D、温度不变时,若压强增大2倍,达到新平衡时,总体积一定比原体积的1/2要小
10、盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO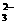 和OH-
和OH-
B、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C、10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
9、常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH)
 LaNi5+6Ni(OH)2,下列说法正确的是
LaNi5+6Ni(OH)2,下列说法正确的是
A、放电时储氢合金作正极
B、放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C、充电时阳极周围c(OH-)增大
D、充电时储氢合金作阴极,并发生氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com