
题目列表(包括答案和解析)
19.(10分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
|
|
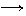 工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
18.(8分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
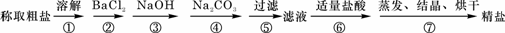
(1)判断BaCl2已过量的方法是_________________________________ 。
(2)第④步中,相关的离子方程式是_____________________________ 。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________ 。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是___________________________________________________。
17.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1-离子是否存在 D.不能确定HCO3-离子是否存在
选择题答案栏
 第Ⅱ卷(非选择题,共62分) 姓名
第Ⅱ卷(非选择题,共62分) 姓名
16.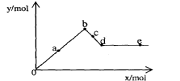 已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3
溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y
与加入Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
15.下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2
D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
14.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
21、(10分)(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH值。
(3)电解至t3时,消耗水的质量。
泰兴市第二高级中学高三月考一
21、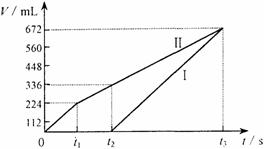 (10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH值。
(3)电解至t3时,消耗水的质量。
(10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH值。
(3)电解至t3时,消耗水的质量。
泰兴市第二高级中学高三月考一
化 学 答 题 纸
纸
|
三 |
四 |
五 |
六 |
总分 |
|
|
|
|
|
|
|
非选择题 |
答题说明:除作图可使用2B铅笔外,其余各题答题时应保持字迹工整、笔迹清楚; |
|||||||||||||||||||||||||||||||||||||||
|
三、(本题包括1小题.共20分) 15、(10分) ①写出以上反应的离子方程式________________________________________________ ②假设a___________ _______________________; 假设b_____________ _____________________。 ③请验证:__________ _____________________________ . ④可以采取的措施有:(至少写四种) ______________________ __________、 _________________________ 、 ___ __、 _ 。 16、(10分) (1)根据步骤Ⅲ填空: ①氮的质量分数 (填“偏高”、“偏低”或“无影响”)。 ②用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”) ③眼睛应观察 (选A或B) ④酚酞指示剂由 色变成 色。 (2)则该样品中氮的质量分数为 四、(本题包括2小题。共20分) 17、(12分)回答下列问题: (1)生成PCl3的热化学方程式 (2)PCl5分解的热化学方程式 , 其分解率α1等于 ;α2 α1 (3)原因是 。 (4)△H3=_______ __, △H4__ _△H3(填“大于”、“小于”或“等于”)。 (5)其化学方程式__________________ _______。 18、(8分) (1)C的体积分数是 (用含字母a的代数式表示)。 (2)C的物质的量为 mol,与原平衡相比 (3)则还应加入C mol。 五、(本题包括3小题.共22分) 19、(12分) ⑴△H= kJ·mol-1。 ⑵电池反应方程式为 ;CO32-移向_____ ___极。 ⑶平衡常数K1= 。(已知:10-5.60=2.5×10-6) ⑷溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 。 20、(10分) (1)水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”) (2)试填写表中空白:
20、(10分)室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。 (1)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”) (2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白:
19、(12分) 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。 ⑴丙烷脱氢可得丙烯。 已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1 CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1 则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。 ⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的________(填“正”或“负”)极。 ⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 ⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |