
题目列表(包括答案和解析)
22.(9分)
氯化银、氢氧化银都能和氨水反应生成Ag(NH3)2+,Ag(NH3)2+能和H+反应:
Ag(NH3)2+ + 2H+=Ag+ +2NH4+,今有一白色固体可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的两种或三种组成,为了确定该白色固体的成分,进行以下实验:
①取白色固体少许,加入适量蒸馏水,充分振荡得无色溶液;
②取①得到的溶液少许,滴加适量的硝酸,有白色沉淀生成。
由此白色固体必须含有的物质可能有两种组合:
第一种是NH4Cl、_______________________。第二种是_______________________。
在第一种情况下加入足量的稀硝酸时仍有白色沉淀,该白色沉淀是____________。
在第二种情况下加入稀硝酸时也产生白色沉淀,其离子方程式为
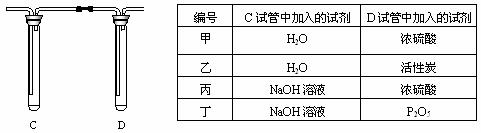
23(6分)贮气袋中存有有色气体,可能是NO2、CH4、CO2、HCl、NH3、Br2蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于AgNO3溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊。则:由①可判断,一定存在___ ______;一定不存在_____ ___。由②可判断,一定存在__ _______;一定不存在_____ ____.由③、④可判断,一定存在___ _____;可能存在的是___ _____。
21、(14分)用右图装置,进行硝酸与铜片反应的实验,同时,
为了防止污染,在试管B里盛放足量氢氧化钠溶液,以吸收反应产生
的气体。
(1)实验前如何检查该装置的气密性?
(2)若实验使用的试剂是质量分数为63%的硝酸和小铜片,操作中怎样加入硝酸和铜片才能避免铜片与硝酸刚一接触时生成的气体外逸到空气中?_______________ _____
______________________________________________________________________________。
(3)若使用的试剂是1mol•L-1的硝酸和小铜片,则A试管中所发生反应的化学方程式是______________________________________________________________________________,实验结束后试管B中的溶液所含的溶质有(写化学式)________________________________。
(4)为了从上述实验中获得纯净的NO,拟用以下装置除去NO中的杂质,最好选用表中的___________(填编号)方法,理由是_______________________________________________
______________________________________________________________________________。
20、要求设计实验证明,某种盐的水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D. 在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
第II卷(非选择题,共80分)
19、在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50mL0.5mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
A、N2O B、NO C、N2O3 D、NO2
18、某温度下,若将Na2SO4溶液蒸发180 g水,可变成饱和溶液。若向该溶液中加入14.2g无水Na2SO4也可变成饱和溶液。若在该溶液中加入Na2SO4·10H2O形成饱和溶液时所需Na2SO4·10H2O的质量可以为
A.14.2 g B.32.2 g C.35.8 g D.46.4 g
17、某学生设计了如图的方法对A盐进行鉴定:
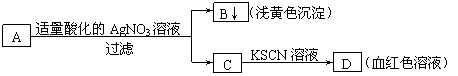
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
16、已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
15、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
A、甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B、甲烧杯中的酸过量
C、两烧杯中参加反应的锌等量
D、反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
14、下列各溶液中,微粒的物质的量浓度关系正确的是:
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
13、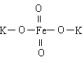 高铁酸钾 是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、
高铁酸钾 是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、
KMnO4氧化更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。 湿法制备的主要反应方程为:2Fe(OH)3 +3ClO -+4OH- =2FeO42- +2Cl- +5H2O , 干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑ 下列有关说法不正确的是: A.高铁酸钾中铁显+3价
B.湿法中每生成1mol Na2FeO4 转移3mol电子 C.干法中每生成1mol Na2FeO4 转移4mol电子 D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com