
题目列表(包括答案和解析)
1、增大表面积可提高反应速率
一定量的固体,其颗粒越小,表面积越大,反应中碰撞的机会越多,反应越快。如燃煤时将大块的煤粉碎后再燃烧可以使煤燃烧得更快、更充分;将硫铁矿粉末高温燃烧;铜丝与硫粉加热反应;与盐酸反应时,大理石粉比大理石块的反应更剧烈;面粉厂车间遇火种易发生爆炸等。
2.活性中心吸附论
合成氨中铁做催化剂时,铁在适当温度,例如500℃-550℃时做为活性中心,吸附氮分子,使氮分子的化学键变弱,进而使化学键破裂而离解为氮原子。气体氢分子与铁表面吸附的氮原子作用,逐步反应形成氨,可表示为:
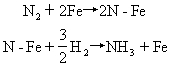
上述反应过程需要的活化能降低了,使活化分子百分数增高,因而反应速率大大增加。
在有气体参加的反应中,使用催化剂,由于催化剂中心的吸附产生中间产物,并使反应物在活性中心周围的浓度增大,活化分子增多,有效碰撞机会增大,从而使反应速率增大。以上两个学说是与有效碰撞理论有关的。
1.中间产物论
例如:二氧化锰催化氯酸钾的分解反应,二氧化锰亦参加了化学反应,形成了中间产物。
首先是氯酸钾和二氧化锰生成高锰酸钾、氯气和氧气:
2KClO3+2MnO2====2KMnO4+Cl2+O2
高锰酸钾进一步分解:
2KMnO4====K2MnO4+MnO2+O2
形成的锰酸钾与氯气反应:
K2MnO4+Cl2====2KCl+MnO2+O2
总起来为:
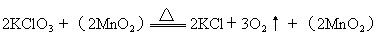
由于二氧化锰参加反应,使得活化能降低,从而大大加快反应速率。
这一理论对实验室制氧气时产生的现象能很好地解释。例如制造出的氧气有氯气的味道。最后剩余产物溶于水后的溶液呈淡紫色。说明中间产生氯气和高锰酸钾有一定的道理。
据研究,在一定温度下,气体分子具有一定的平均能量,但不是所有分子都具有这样大的能量的,有的分子能量高些,有的分子能量低些。只有极少数具有能量比平均值高得多的分子,它们才能发生有效的碰撞;也就是说,碰撞后才能引起反应,这样的分子叫做活化分子。活化分子具有的最低能量,与同温度下分子的平均能量之差叫做活化能,这是反应物分子在一定条件下进行反应,所必须具备的能量。不同的反应,具有不同的活化能,反应的活化能越低,活化分子的百分数就越大,反应就越快。活化能的单位通常是kJ/mol。例如,实验测得:
2SO2+O2=2SO3反应的活化能为209kJ/mol
2N2O5=4NO2+O2反应的活化能为100.32kJ/mol
活化分子和活化能的概念,可用来解释浓度、温度等因素对反应速率的影响。对某一反应来说,在一定温度下,活化分子在反应物分子中所占的百分数是一定的。因此,单位体积内活化分子的数目,是和单位体积内反应物分子的总数成正比,也就是和反应物的浓度成正比。显然,当反应物的浓度增大时,单位体积内活化分子的数目也相应地增多,这样也就增加了单位时间内有效碰撞的次数,因此反应速率加快。另外,如果升高反应温度,则分子运动加快,从而增加了单位时间内分子间的碰撞次数;更重要的是由于一些分子获得了能量,增加了活化分子的百分数,因而加快了反应速率。
至于催化剂加快反应速率的原因,乃是由于降低了反应的活化能,增加了活化分子的百分数的缘故。
4、影响化学平衡的条件:
化学平衡状态是与外界条件有关的。外界某种条件改变时,使正、逆反应速率不等,平
衡混合物中各组成物质的百分含量(或浓度)也随之改变,原来的平衡被破坏直到建立新条
件下的另一种平衡状态。这种改变的过程,叫化学平衡的移动。影响化学平衡的主要条件有
______、______、_____。
疑难点拨
3、化学平衡的特点:“_、__ 、__ ”
a.反应物与生成物处于动态平衡,在化学平衡状态,可逆反应的正反应和逆反应都还在不断的进行着,只是此时V正=V逆(且都大于0)。而不是停止了化学反应。
b.在化学平衡状态,任何反应物与生成物浓度保持一定,百分组成保持一定;(或说反应物与生成物的含量保持一定)
c.影响平衡的外界条件改变,平衡状态即被破坏,发生平衡移动。
2、 当一个可逆反应的__________________相等时,________________不再改变,达到一种“平衡状态”,这就是这个反应所能达到的限度。
任何化学反应都有一定的限度,有的反应限度较大,反应进行的比较彻底,反应物转化为生成物的转化率较大;有的反应限度较小,反应物转化为生成物的转化率较小。
1、可逆反应:能同时向________________________进行的化学反应叫做可逆反应。理解可逆反应需注意三同:同__、同__、同____。
3、应用化学反应速率需注意以下问题:
(1)化学反应速率是标量,只有___而没有___;
(2)一般计算出来的化学反应速率是一段时间内的___速率,不同时刻的化学反应速率
是不相同的;
(3)固体或气体反应中的液体物质,反应在其表面进行,它们的“浓度”是___变的,
因此一般___用固体、纯液体表示化学反应速率;
(4)对于同一化学反应,用不同的物质表示其化学反应速率可能___相同,但其化学反应速率之比等于__________之比。
2、影响化学反应速率的因素:
|
影响化学反应速率的因素 |
规律 |
|
|
内因 |
反应物的性质 |
|
|
外 因 |
催化剂 |
|
|
反应物的温度 |
|
|
|
反应物的浓度 |
|
|
|
气态反应物的压强 |
|
|
|
固体反应物的表面积 |
|
|
|
其他 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com