
题目列表(包括答案和解析)
21.(10分)在装修居室时,如使用不合格的建筑、装潢材料,易造成“室内空气污染”,影响人们身体健康,造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡等。学好化学有助于我们设法减少居室内的空气污染,消除空气中的有害物质对人体可能产生的影响。回答下列问题:
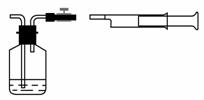 (1)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
(1)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
①请你帮助小陈同学选择装置中试剂瓶内的药品:_____(填序号);
a.银氨溶液 b.酸性高锰酸钾溶液 c.新制得氢氧化铜悬浊液
根据你的选择,为使实验现象明显,你认为对所选择试剂的浓度有什么要求__________________________________________________________________;
②在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作:________________________________________________________;
③若试剂瓶内溶液的体积和浓度已知,实验时还需测定的数据有:
_______________________________、________________________________;
(2)请你提出减少室内空气污染的措施:____________________________________;
20.(10分)下图是部分元素的单质及其化合物的转化关系图(有关反应的条件及部分反应物或生成物已略去);
已知:C、D、F均为单质,其中C、D在常温、常压下是气体;反应②是化工生产中的重要反应,生成物E具有漂白性;J、K均为不溶于水的沉淀,其中J为红褐色。
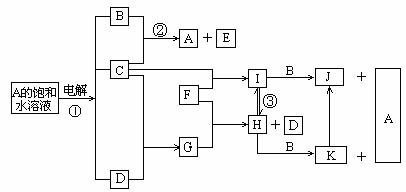
请回答下列问题:
(1)A的电子式:_______________;
(2)反应②的离子方程式是___________________________________;
(3)反应③的化学方程式是____________________________________;
(4)实验室由H制备少量K的方法:是用胶头滴管吸取B溶液,将滴管尖端插入盛有新制H溶液试管底部,慢慢挤出B溶液即可,观察到的现象为:
________________________________________________________;
(5)当有1.12L(标准状况)D生成时,反应①中转移的电子数为___________;
19.(8分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
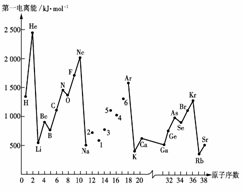
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中5号元素在周期表中的位置是________________________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________。
18.(12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
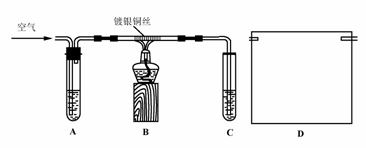
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将甲装置浸在70-80℃的水浴中,目的是____________________________;
②装置B、C之间接上丁装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:____________。
17.(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:______________________________________;
(3)步聚2中,判断加入BaCl2已过量的方法是:
________________________________________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
________________________________________________;
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是___________________、_____________________。
16.在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
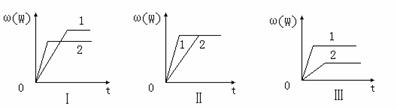
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
第Ⅱ卷(选择题 共86分)
15.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
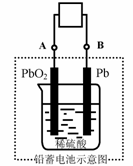 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
14.近年来南通建设了多个主题广场,为市民提供了夏夜纳凉的好去处,夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
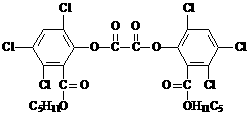
下列有关说法正确的是
A.草酸二酯属于芳香族化合物
B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
13.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7,
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
12.一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、HCO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com