
题目列表(包括答案和解析)
6、在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将固体块状反应物磨成末⑤增大压强
A、①②③⑤ D.①②④⑤ C①③④⑤ D①②③④
5、100 mL 6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的
A、碳酸钠 B、水 C、硫酸钾溶液 D、烧碱溶液
4、铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A、0.02 mol/(L•min) B、1.8mol/(L•min) C、1.2 mol/(L•min) D、0.18 mol/(L•min)
3.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO+O2 2NO2
B.N2O4
2NO2
B.N2O4
 2NO2
2NO2
C.Br2(g)+H2  2HBr
D.6NO+4NH3
2HBr
D.6NO+4NH3  5N2+3H2O
5N2+3H2O
2、下列说法不正确的是
A.物质发生化学反应都伴随着能量变化。
B.化学反应的速率和限度均可通过改变化学反应条件而改变。
C.可逆反应只是代表少数反应。
D.化学反应达到平衡状态时,正反应速率与逆反应速率相等。
1、NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是
A、使用适当的催化剂不改变反应速率 B、降低压强能提高反应速率
C、高温度能提高反应速率 D、改变压强对反应速率无影响
5、超声波射线、激光、电磁波等对反应速率均有影响。
超声波作为一种高频机械波,具有波长较短,能量集中 的特点. 可利用超声波增大物质分子运动频率和速度。超声波具有强烈的乳化作用,并能起到均匀搅拌、研磨粉碎和加速化学反应的作用。
激光具有单色性、高强度和短脉宽等优越性能,是诱发光化学反应最理想的光源。例如,激光光解可以产生自由基或原子,所产生的自由基又可以诱发链锁反应。
典例剖析
[例1] 对于反应N2+O2  2NO在密闭容器中进行,下列哪些条件能加快反应的速率
2NO在密闭容器中进行,下列哪些条件能加快反应的速率
A. 缩小体积使压强增大 B. 体积不变充入N2使压强增大
C. 体积不变充入H2使压强增大 D. 压强不变充入N2使体积增大
解析:对有气体参加的化学反应,增大压强如果能增大反应物的浓度,则可以加快反应速率,AB均如此。C选项充入氢气,虽然压强增大,但反应物浓度不变,D选项体积增大,减小了氧气的浓度,也不加快反应。答案:AB。
[例2]温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量浓度增加了0.3mol,则此反应的平均速率 (x)为
A、v(O2)=0.01mol/(L·s) B、v(NO)=0.08mol/(L·s)
C、v(H2O)=0.003mol/(L·s) D、v(NH3)=0.002mol/(L·s)
解析:根据化学方程式4NH3+5O2 4NO+6H2O,NO的物质的量增加了0.3mol,则H2O增加了0.45mol,NH3和O2分别减少了0.3mol和0.375mol。所以,用反应中各气态的反应物和生成物表示的该反应的化学反应速率分别为:
v(NH3)= =0.002mol/(L·s) v(O2)= =0.0025mol/(L·s)
v(NO)= =0.002mol/(L·s) v(H2O)= =0.003mol/(L·s)
可见,本题的正确答案是CD。
[例3]一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
A. X、Y、Z的物质的量之比为1:2:2 B. X、Y、Z的浓度不再发生变化
C. 容器中的压强不再发生变化 D. 单位时间内生成n molZ,同时生成2n molY
解析:达到化学平衡状态是指各组分浓度不变的状态,此时本题中压强也不再变化,而D选项表示反应向逆反应方向进行,没有达到平衡。答案:BC。
[例4]一密闭容器内装有N2和H2 ,反应开始时,N2浓度为2 mol/L,H2浓度为5mol/L ,两分钟后,测得N2浓度为1·8mol/L ,则两分钟内N2的平均反应速率是多少?H2和NH3的平均反应速率又分别是多少?通过计算,比较三者速率有何联系?
解析: N2 + 3 H2  2NH3
2NH3
起始浓度(mol/L) 2 5 0
浓度变化(mol/L) 0·2 0·6 0·4
2 min后浓度(mol/L) 1·8 4·4 0·4
所以:v(N2)=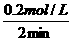 =0·1 mol/(L·min)
=0·1 mol/(L·min)
v(H2)=0·3 mol/(L·min) v(NH3)=0·2 mol/(L·min)
知能训练
4、采用不同的溶剂可改变反应速率
研究溶液中反应要考虑溶剂分子所起的物理的或化学的影响。溶剂的极性对反应速率存在影响。如果生成物的极性比反应物大,则在极性溶剂中反应速率比较大;反之,如反应物的极性比生成物大,则在极性溶剂中的反应速率必变小。如甲醇羰基化反应,在非极性溶剂中、介电常数较小的溶剂能增加反应速率;另如CH3COCl与苯酚反应当以硝基苯为溶剂时主要产品为对位,当以CS2为溶剂时主要产品为邻位。CH3CH2Cl在NaOH水溶液中发生水解反应,在NaOH醇溶液中发生消去反应。
3、电化学原理增大反应速率
在相同条件下,电化学反应比化学反应的反应速率快得多。如粗锌跟盐酸反应速率比纯锌快,这是由于粗锌中杂质与Zn构成原电池加快反应速率,不纯金属易被腐蚀原因也由于杂质(C)与金属(Fe)构成原电池。利用电化学原理也可使几乎不发生反应能进行反应,如铜与盐酸反应,可设计成原电池,也可设计成电解池。另如在水中加入强酸或强碱都可使电解水的速率加快。人们可利用电化学原理增大有利的化学反应速率,也可利用电化学原理减弱有害的化学反应速率,如牺牲阳极保护金属法。
2、加大光照强度提高反应速率
氯水、AgBr、HClO、浓HNO3等见光分解加快,强光照射H2与Cl2混合气体、甲烷与Cl2混合气体易发生爆炸等。光照还是光化学烟雾形成的主要原因,光化学烟雾是氮氧化物和碳氢化合物(CXHY)在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com