
题目列表(包括答案和解析)
3.反应后所得溶液中溶质的质量分数。
 解析与答案
解析与答案
解析:解好有关化学方程式的计算题的关键应从下面3点出发:
2.被氧化成氧化钠的金属的质量是多少克?
1.未被氧化的金属钠的质量是多少克?
1. 钠
钠
 例题2-1-1
例题2-1-1
把一小块金属钠暴露在空气中,观察到以下现象:
①金属钠表面逐渐变暗;
②过一段时间以后又逐渐变潮湿;
③再过些时候又变成白色固体;
④又过一段时间白色固体变成白色粉末。
试写出以上发生的各种现象的有关方程式。
 解析与答案
解析与答案
金属钠为活泼金属,极易被空气中的氧气氧化生成氧化钠,所以表面逐渐变暗且无光泽;氧化钠在空气中溶于水,表面变潮湿而生成氢氧化钠;氢氧化钠和空气中的二氧化碳和水蒸气反应,生成碳酸钠晶体,即含有10个结晶水的碳酸钠;再过一段时间,含有结晶水的晶体风化失水而变成粉末状物质。
答案: ①4Na+O2=2Na2O;
②Na2O+H2O=2NaOH;
|
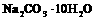 ;
;
④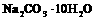 =Na2CO3+10H2O。
=Na2CO3+10H2O。
 例题2-1-2
例题2-1-2
将一定质量的钠投入到12.3g t℃H2O中,得到t℃时的NaOH饱和溶液15.6 g。试计算:①该温度
下NaOH溶液的溶解度是多少? ②反应掉Na的质量是多少克?
 解析与答案
解析与答案
此题未给出实际参加反应的Na的质量,有一定的难度,最好的方法就是差量法求出生成的NaOH的质量,反应掉水的质量,继而求出溶解度。
设:反应掉Na、H2O的质量为x、y,生成NaOH的质量为z,
2Na + 2H2O = 2NaOH + H2↑ 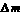
2×23 2×18 2×40 44
x y z 15.6-12.3=3.3
列式,求得x=3.45g,y=2.7g,z=6g
所以S(NaOH)=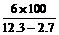 =62.5g
=62.5g
答案:①该温度下NaOH的溶解度为62.5 g;
②反应掉3.45 g Na。
 例题2-1-3
例题2-1-3
取一支大试管,加入15mL的水与苯(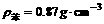 ),静置。取黄豆大的金属钠(
),静置。取黄豆大的金属钠(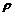 Na=
Na=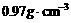 ),轻轻放入这支装有水和苯的试管,试推测能观察到的实验现象是____________________。
),轻轻放入这支装有水和苯的试管,试推测能观察到的实验现象是____________________。
 解析与答案
解析与答案
因为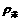 <
<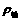 <
<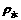 ,所以当将Na块轻轻放入这支装有水和苯的试管时,钠刚好落在界面上。又由于Na与水反应有H2产生,H2又使Na块上浮,当附着在Na块表面的H2逸出后,Na块又下沉到界面上,又发生反应,重复发生上述现象直至钠块反应耗尽,逐渐消失。
,所以当将Na块轻轻放入这支装有水和苯的试管时,钠刚好落在界面上。又由于Na与水反应有H2产生,H2又使Na块上浮,当附着在Na块表面的H2逸出后,Na块又下沉到界面上,又发生反应,重复发生上述现象直至钠块反应耗尽,逐渐消失。
答案:钠块在苯和苯、水的界面上下起伏,并有气泡产生。

 例题2-1-4
例题2-1-4
为防止药品变质,实验室通常采用密封的方法保存药品。少量的金属钠是放在盛有煤油的广口试剂瓶中,而不是直接放在密封的广口瓶中。
(1) 请解释原因;
(2) 若金属钠直接露置在空气中,有下列现象:a. 变成白色粉末 b. 变暗 c. 变成白色固体 d. 固体表面变潮湿,上述现象出现的先后顺序是_____。
 解析与答案
解析与答案
本题是利用钠的性质,解决实际问题。

|

|
|
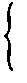
|
2Na + O2 ==Na2O2
2Na + S=Na2S
与化合物 2Na + 2H2O=2NaOH + H2↑
2Na + 2HCl=2NaCl + H2↑
分析:Na有强还原性,可直接与空气中的O2和H2O反应,因此在保存少量钠时,必须禁止Na直接与空气接触。
若直接放在空广口瓶中,Na也可以与瓶内空气中的O2和少量水蒸气反应。而放在煤油中,因Na的密度大于煤油,且不与煤油反应,所以沉在煤油下面,通过煤油与空气隔绝。
若Na露置在空气中,发生的主要变化为:
|
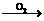 Na2O
Na2O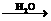 NaOH
NaOH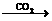 Na2CO
Na2CO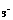 10H2O
10H2O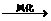 Na2CO3
Na2CO3
银白色 变暗 潮解吸水 白色固体 白色粉末状
通过反应,推断现象。
答案 (1) 钠的密度大于煤油,沉在煤油下面,且钠不与煤油反应,所以通过煤油,将钠与空气和水隔绝。少量的钠放在空瓶中,即使是密封瓶中也含有氧气,钠会与氧气反应而变质。
(2) b、d、c、a
 例题2-1-5
例题2-1-5
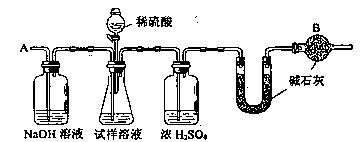
 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: ①钠的物理性质;
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: ①钠的物理性质;
②钠与水反应的产物是什么。
(1)当进行适当操作时还需要的仪器有____________。
(2)如何进行操作?_______________。
 解析与答案
解析与答案
(1) 由于实验目的是做钠和水的反应,验证钠的物理性质并验证钠和水反应的产物是什么,所以要收集产生的气体, 并验证气体的可燃性。
(2) 要由钠和水反应来验证钠的物理性质,使自由的钠块与水接触,就要想办法将钠块放入水中。
答案 (1) 还需要小试管和酒精灯。
(2) 将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇 指堵住试管口移近酒精灯,松开拇指点燃试管中的气体。
 例题2-1-6
例题2-1-6
将4.6g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热,反应后生成的固体是( )
A.黄色固体混合物 B.氧化钠与硫化钠
C.硫与硫化钠 D.过氧化钠与硫化钠
|
 解析与答案
解析与答案
本题容易错认为只发生:2Na+S==Na2S这个反应,而并未注意条件中: ①钠是过量的;②未隔绝空气对反应物进行加热。全面考虑后,在加热条件下,钠既能与硫化合生成Na2S,也能与空气中的氧气反应生成Na2O2,钠又是过量的,故生成物是Na2O2和Na2S的混合物。
答案 D
 例题2-1-7
例题2-1-7
有一块表面被氧化成氧化钠的金属钠,质量是10.8g。将它投入到100g水中完全反应后,收集到0.2g氢气,试计算。
29.(12分)将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH=
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
n (NO2) = n (NO) =
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO+2NaOH=2NaNO+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围
28、(16分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:请填写下列空白:
(1)写出下列物质的化学式:
A、 D、 F、____________________
J、 K、
(2)写出下列反应的离子方程式:
a、H+E(溶液)→M 。
b、反应④ 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
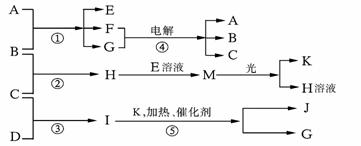
27.(15分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴在用托盘天平称量样品时,如果天平的指针向右偏转,说明_____________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________,
如果将试剂瓶中的NaOH溶液换成饱和NaHCO3溶液,测试的结果 (填偏高、偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
26.(17分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:(1)写出下列元素的元素名称:
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量热NaOH溶液反应的离子方程式 。
(5)将8g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
13.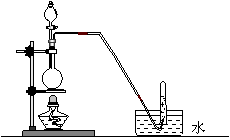 下列气体的制备可采用右图装置的是
下列气体的制备可采用右图装置的是
A.铜与浓硝酸反应制NO2
B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯
D.氯化钠与浓硫酸反应制HCl
12、下列有关叙述中正确的是
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.C和Si同主族,所以CO2和SiO2 都是由极性键构成的非极性分子
C.S8和SiO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.若IIA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数有可能为m+11
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com