
题目列表(包括答案和解析)
2.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是
A.HCl B.CuSO4 C.K2SO4 D.NaOH
1.下列说法正确的是
A.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔
B.碘盐中的碘可以直接用淀粉检验
C.碳酸氢钠可用于治疗胃酸过多
D.硫酸氢钠属于盐类,其水溶液显中性
2.20 g y x
x=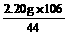 =5.30 g y=
=5.30 g y=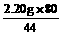 =4.00 g
=4.00 g
剩余固体NaOH的质量为:6.00 g-5.30 g=0.70 g
所以两种组成的质量分数分别为:
w
(Na2CO3)=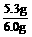 ×100%=88%
×100%=88%
w (NaOH)=100%-88%=12%
NaOH溶液的质量分数为: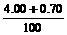 ×100%=4.7%
×100%=4.7%
答案: (1) 第一份的固体组成:w (Na2CO3)=77%,w (NaHCO3)=23%;第二份固体组成w (Na2CO3) =88%,w (NaOH)=12%
(2) 第一份NaOH溶液的质量分数为3.5%,第二份NaOH溶液的质量分数为4.7%
 例题2-23
例题2-23
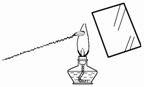
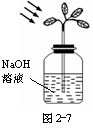 如图2-7所示,用来验证绿色植物进行光合作用的实验装置,先将这个装置放在暗室里24 h,然后移到阳光下;瓶子内盛有NaOH溶液,瓶口密封。
如图2-7所示,用来验证绿色植物进行光合作用的实验装置,先将这个装置放在暗室里24 h,然后移到阳光下;瓶子内盛有NaOH溶液,瓶口密封。
(1)经过相当长的一段时间以后,摘下植物的叶片,经过处理后加碘液数滴而叶片颜色无变化,证明液片中__________,说明了__________。
(2)瓶内放NaOH的作用是_____;将绿色植物放置24 h的作用是_____________。
(3)若瓶内析出m g白色沉淀,说明_____,发生反应的化学方程式为__________,将此沉淀加热,可得到多少克CO2气体?
 解析与答案
解析与答案
叶片经处理后加碘液不变色,说明叶片中无淀粉。淀粉遇碘变蓝,这是淀粉的特性。
此时淀粉已被消耗,考虑光合作用的暗反应过程,CO2固定和还原均需要酶参与催化,这个过程消耗了淀粉。
|
2NaHCO3=Na2CO3+CO2↑+H2O。
答案: (1) 无淀粉; CO2是光合作用的原料。
(2) 吸收CO2;消耗植物体内原有淀粉。
|
2NaHCO3=Na2CO3+H2O+CO2↑
2×84 44
m g x
x=
1.40g 1.79g
x=24.3
所以,该碱金属的相对原子质量应满足24.3<x<61.03,只有K符合。
设a、b分别为K和K2O的质量:
依反应方程式得 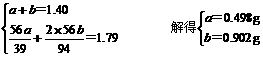
∴w(K)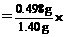 100%=35.6%
100%=35.6%
 例题2-3-9
例题2-3-9
有一在空气中暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO3 4.32%,其余是NaOH,若将1g该样品放入含有3.65g HCl的盐酸中,使其完全反应后,多余的酸再用50g浓度为 2%的NaOH溶液恰好中和完全,蒸发所得溶液至干,求所得固体的质量。
 解析与答案
解析与答案
此题数据众多,反应繁杂,若使用传统计算方法,耗时多,效率低。如果依反应过程分析体系中粒子的种类,结合元素原子守恒,

存在Cl元素守恒: NaCl Cl-
Cl- HCl
HCl
1.40g 1.79g
x=61.03
若1.40g只是M2O: M2O +H2O=2MOH
2x + 16 2 (x+17)
(x+17)
1.2
O2 - 1 0.8
所以:n(O2 2-)∶n(O2 -)=1∶4
答案:C
 例题2-3-4
例题2-3-4
某物质的分子组成为CxHyOz,取该物质m g在足量的O2中充分燃烧后,将产物全部进入过量的Na2O2中,若Na2O2固体的质量也增加mg,则该物质分子组成中必须满足( )
A. x=y=z B. x=y C. y=z D. x=z
 解析与答案
解析与答案
根据质量守恒首先将此化合物的燃烧方程写出:
CxHyOz +( x +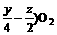 →xCO2 +
→xCO2 + 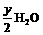
2CO2 + 2Na2O2=2Na2CO3 + O2
x
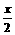
2H2O + 2Na2O2=4NaOH + O2↑
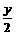
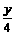
要达到题目中的要求需:
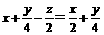
x=z
答案:D
 例题2-3-5
例题2-3-5
金属钾在氧气中燃烧生成超氧化钾KO2,KO2与CO2或H2O反应均生成O2。先将一定量的钠钾合金在足量氧气中燃烧,再将反应物投入水中,并通入足量的CO2,充分反应后,放出氧气的最大体积是被吸收的CO2最大体积的 ,则原钠钾合金中钠和钾的质量比为( )
,则原钠钾合金中钠和钾的质量比为( )
 解析与答案
解析与答案
|
K + O2=KO2
4KO2 + 2H2O=4KOH + 3O2↑
CO2 + KOH=KHCO3
|
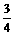 O2,由1个钾原子生成O2与消耗CO2的体积比为
O2,由1个钾原子生成O2与消耗CO2的体积比为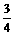 ,
,
同理:4Na + O2=2Na2O2
2Na2O2 + 2H2O=4NaOH + O2↑
NaOH + CO2=NaHCO3
合并化简得:4Na-2Na2O2-4CO2-O2即Na-CO2-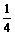 O2,由1个钠原子生成O2与消耗CO2的体积比为
O2,由1个钠原子生成O2与消耗CO2的体积比为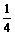 ,
,
K 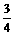
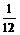

Na 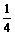
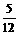
所以钾原子个数与钠原子个数比为1∶5
m(Na)∶m(K)=5×23∶39=115∶39
答案:115:39
 例题2-3-6
例题2-3-6
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。试综合上述命名规律,分析回答:Na2CS3应读做( )
A.硫代碳酸钠 B.多硫碳酸钠
C.过硫碳酸钠 D.超硫碳酸钠
 解析与答案
解析与答案
此题为信息迁移题。据题意分析:硫代硫酸钠(Na2S2O3)表明Na2SO4分子中的一个氧原子被一个硫原子代替,代替氧的硫原子化合价仍为-2价,而多硫化钙表明普通硫化钙又与硫结合后的产物,硫的价态发生了改变;过氧化物中含有过氧根离子即O2 2-,超氧化物中含有超氧根离子即O2 -,它们的价态都与原先氧的价态不同,综上分析应选A。
答案:A
 例题2-3-7
例题2-3-7
某物质灼烧时,焰色反应呈黄色,下列判断正确的是( )
A.该物质一定含钠元素
B.该物质一定是钠的化合物
C.该物质一定是金属钠
 D.不能确定该物质中是否含钾元素
D.不能确定该物质中是否含钾元素
 解析与答案
解析与答案
焰色反应的作用是检验某些金属或金属离子的存在。
焰色为黄色证实有Na元素,可能是单质,也可能是化合物。K元素的确定应是: 透过钴玻璃滤去黄光呈紫色。
答案 A、D
 例题2-3-8
例题2-3-8
将1.40g碱金属(M)及其氧化物(M2O)的混合物与水反应,蒸发、结晶得干燥的MOH1.79g。
(1) 该碱金属是何种金属?
(2) 混合物中碱金属单质所占的质量分数。
 解析与答案
解析与答案
解析:由于碱金属不能直接确定,传统解法中可采用排除法进行计算,就是将每一种碱金属逐一代入进行尝试,缺点是计算繁杂、耗时多。
另一种方法就是采用极限讨论法:假定1.40g只是碱金属或只是氧化物,分别求得两种情况时碱金属的相对原子质量,再进行比较分析、判断。
解: 设M的相对原子质量为x,M2O的相对原子质量为2x+16
若1.40g只是碱金属:2M+2H2O=2MOH+H2↑
2x 2 (x+17)
(x+17)
10.8 g 16 g
列出比例求得M=10.69
由平均值原理:10.69<M<35.3,符合此条件的碱金属是钠。
(2) 设10.8 g混合物中Na和Na2O质量分别为x g,yg,则:

解得: M(Na)=x=4.6 g
M(Na2O)=y=6.2 g
答案: (1)此碱金属为钠
(2)M(Na)=4.6 g M(Na2O)=6.2 g
 例题2-3-3
例题2-3-3
铷在氧气中剧烈燃烧生成棕色的过氧化铷(Rb2O2)和深棕色的超氧化铷(RbO2)的混合物。测得某次燃烧后所得混合物中铷的质量分数为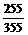 则其中过氧根离子(O22-)和超氧根离子(O2-)的物质的量之比为(
)
则其中过氧根离子(O22-)和超氧根离子(O2-)的物质的量之比为(
)
A. 1∶1 B. 4∶1 C. 1∶4 D.任意比
 解析与答案
解析与答案
根据题意,在混合物中Rb+与O22-及O2-的物质的量之比为:
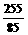 ∶
∶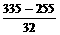 =3∶2.5,那么在混合物中两种
=3∶2.5,那么在混合物中两种
氧离子的平均化合价为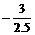 =-1.2,根据十字交叉法:
=-1.2,根据十字交叉法:
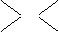 O2 2- 2 0.2
O2 2- 2 0.2
10.8 g 16 g
列出比例求得M=35.3
假设10.8g全部是该金属氧化物R2O,则:
R2O + H2O=2ROH
2M + 16 2(M + 17)
7.8 g 0.2 g
得: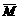 =39
=39
由于合金的平均相对原子质量为39,铷的相对原子质量是85.5,所以另一种碱金属的相对原子质量必定小于39。Li为6.9,Na为23,符合题意。
答案:A、B
 例题2-3-2
例题2-3-2
取10.8 g由碱金属(B)及其氧化物(R2O)组成的混合物,使之与足量的水反应,蒸发后溶液得16.0g无水晶体。问:(1)该金属是哪种金属?(2)原混合物中R和R2O的质量各是多少?
 解析与答案
解析与答案
解决此题可用“极端假设”法,其依据仍为平均值原理。
设: 此碱金属的相对原子质量为M,则16 g的固体为ROH。
(1) 假设10.8 g全部是碱金属R,则:
2R + 2H2O = 2ROH + H2↑
2×M 2(17+M)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com