
题目列表(包括答案和解析)
3.(08苏州)下列实验的分析或误差判断正确的是( )
①在中和滴定中若配制的标准NaOH溶液中含少量杂质Na2CO3,会使测定的待测HCl溶液的浓度偏低。
②为了测定Cu与浓H2SO4反应产生SO2的量,将反应产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量,此测定的SO2的量偏高。
③为了测定C与浓H2SO4反应所产生混合气体中SO2的含量,将反应产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀,此测定的SO2含量准确。
④测定Cu与浓H2SO4反应产生SO2的量,将反应产生的气体缓缓通入足量Ba(OH)2溶液,反应完全后过滤、洗涤、干燥、称量沉淀,此测定的SO2完全准确。
⑤中和热测定实验中,加厚保温层能减少实验误差。
⑥配制100g10%的CuSO4溶液,在托盘天平上称取10g无水CuSO4固体溶解于90g水中,此实验配制浓度准确。
A.②③⑤ B.①②③ C.②③④ D.②③④⑤⑥
|
的部分内容。据此下列说法正确的是 ( C )
A.该试剂的物质的量浓度为9.2 mol·L-1
B.该硫酸50. 0 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
2.(08连云港)下列关于工业生产说法错误的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
2.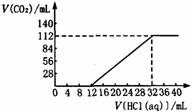 (14分)今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓慢滴加一定浓度的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到右图所示的曲线。试计算:
(14分)今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓慢滴加一定浓度的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到右图所示的曲线。试计算:
(1)混合物中碳元素的质量分数。
(2)所滴加盐酸的物质的量浓度。
1.(10分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506g该混合物加热至质量不再发生变化为止。把放出的气体通入足量的澄清石灰水中,得到0.200g白色沉淀。把加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084g。问: (1)混合物中酸式碳酸盐有_________g(不用写计算过程) (2)加热灼烧后残留固体含碳酸盐___________g(不用写计算过程) (3)通过计算,确定这两种盐的化学式,写出计算和推理过程。
3.(10分) 草木灰中含有碳酸钾,海草灰中含有碘盐,从草木灰中提取碳酸钾,
从海草灰中提取碘,并作有关检验操作:
(1)用石蕊试纸检验溶液的酸碱性,正确的操作方法
(2) 从草木灰中提取钾盐,过滤后的溶液在蒸发皿里加热以得到钾盐晶体,加热过程中要 ,当加热到
时停止加热。
(3)某学生用灼烧后的无锈铁丝沾上了钾盐,但在酒精灯上灼烧时看到火焰是黄色而看不到紫色,这是因为
(4) 将氯气通入海藻灰溶液,溶液变为浅棕色,将CCl4加入该溶液中,充分振荡静置
分层后,下层液体的颜色是
2.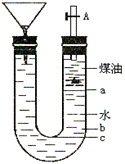 (10分)用右图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的密度为0.97g/mL,煤油的密度为0.87g/mL,请回答下列问题:
(10分)用右图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的密度为0.97g/mL,煤油的密度为0.87g/mL,请回答下列问题:
(1)液体物质添加完毕后,关闭活栓,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在_____处(填a、b、c);
(2)反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因:
(3)写出Na跟水反应的离子方程式
(4)装置中的漏斗在反应过程中的主要作用是_______________;
(5)本实验除能使反应平缓连续进行、收集并检验气体外,还有一个优点是
。
这是因为___________________________________________ _。
1. (8分) 现有失去标签的四瓶无色溶液A.B.C.D,只知它们是K2CO3、K2SO4、NaHSO4和Ba(NO3)2,为鉴别它们,进行如下实验.
①A+D 溶液+气体; ②B+C
溶液+气体; ②B+C 溶液+沉淀;
溶液+沉淀;
③B+D 溶液+沉淀; ④A+B
溶液+沉淀; ④A+B 溶液+沉淀.
溶液+沉淀.
将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体.根据以上实验事实,请回答如下问题:
(1)A.B.C.D四种无色溶液分别为:________、________、________、________.(用化学式表示)
(2)离子方程式为:①__________________
⑤___________________
16. 将过量CO2通入下列溶液中,最终没有沉淀产生的是 ( )
A、饱和NaOH溶液 B、饱和Na2CO3溶液 C、CaCl2 D、NaAlO2溶液
选择题答案表:
15. 为了测定某碱金属M的相对原子质量,设计了如右图所示的装置。仪器本身连同水
为了测定某碱金属M的相对原子质量,设计了如右图所示的装置。仪器本身连同水
的质量为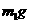 。若向瓶中投入
。若向瓶中投入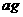 金属M,实验完毕后,测得装置的质量为
金属M,实验完毕后,测得装置的质量为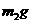 。
。
则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是( )
A. 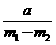 、偏小 B.
、偏小 B. 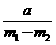 、偏大
、偏大
C.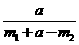 、偏大 D.
、偏大 D.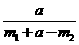 、偏小
、偏小
14.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将6.9g样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到4.5g沉淀.对样品所含杂质的正确判断是( )
A.肯定有KNO3
B.肯定有KNO3 Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com