
题目列表(包括答案和解析)
26、 (1)化学方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 2’
(1)化学方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 2’
简述理由:_反应中浓硫酸不断消耗,且有水生成,使浓硫酸变稀,铜和稀硫酸不反应 1’_。
可以证明有余酸的实验方案是__A D 2’___。
(2)方法①将A中产生的气体用排水法测定其产生气体体积(折算成标准状态)_1’ _;
方法②将D中产生的气体用排饱和碳酸氢钠溶液的方法测定其产生气体体积(折算成标准状态)_1’__。
(3)离子反应方程式:_Cu2+ + S2- → CuS↓ 1’
B可能__大于____1’___A(填写“大于”“小于”或“等于”)
用化学方程式说明原因_2H2SO4(浓)+ Na2S → Na2SO4 + SO2↑ + S↓+ 2H2O 2’ _。
(4)尚缺少的测量数据是_烧瓶中反应后溶液的体积 1’ _
11.某化学课外兴趣小组探究铜跟浓硫酸的反应情况:
取6.4g铜片和10ml 18mol/L浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时他们根据所学的化学知识认为还有较多的硫酸剩余。
(1)请写出铜跟浓硫酸反应的化学方程式:___________________________。试问:为什么较多的余酸不与铜继续反应?简述理由:__________________
(2)可以证明有余酸的实验方案一是___________。(填写字母编号,多选扣分)
A、再加入足量镁粉 B、再滴入BaCl2溶液 C、再加入银粉 D、再滴入Na2CO3溶液
在上述可证明存在余酸的实验方案中,继续通过测定生成气体的量即可确定余酸的浓度,测定方法有多种,方法①_____________________________②_________________
(3)可以证明有余酸的实验方案二是:测定反应后混合溶液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤出沉淀,洗涤,干燥,称量为A克。
写出生成沉淀的离子反应方程式:_____________________________。如果在反应后的溶液中直接加入足量Na2S溶液,充分反应后,,过滤出沉淀,洗涤,干燥,称量为B克,则B可能_________A(填写“大于”“小于”或“等于”),用化学方程式说明原因____________________________________。
(4)上述实验方案中,能够计算余酸浓度的数据除测算产生气体的物质的量或反应掉铜的物质的量外,尚缺少的测量数据是______________________________
15.(14分)
(1)冷凝、回流(1+1分)。防止倒吸(2分)。
|
(2)S+2H2SO4(浓) 3SO2↑+2H2O(2分,无加热符号、气体符号扣1分)
(3)取样后,向其中加入氯氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可)(2分)
(4)CuO、CuS、Cu2S(或CuO、CuS可CuO、Cu2S)(2分)
(5)铜与浓硫酸反应的实验中硫酸过量使溶液呈酸性(2分)。取稀释后的溶液适量于试管中,加入足量的铁粉,若有无色无味的气体产生,证明硫酸过量(开放题,正确即可)
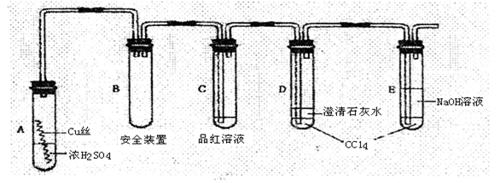
10.(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流滴录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝成硫发生了反应,我查资料发现:2Cu+S=Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
。
3.[答案](12分)(1)冷凝、回流。防止倒吸。(共4分,各2分)
(2)S+2H2SO4(浓)═3SO2↑+2H2O(2分)
(3)由于SO2溶解度较大,生成了Ca(HSO3)2溶液的缘故。(2分)取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可给分。2分)
(4)CuO、CuS、Cu2S(共2分,完全正确给2分,对1-2个给1分)
9、(08盐城模拟)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
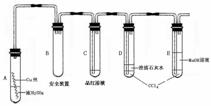
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
 以下是该学习小组部分交流记录及后续探究实验的记录
以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:________ ___ 。
设计实验验证你的猜想________________ 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
8.B.(12分)(实验化学)硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
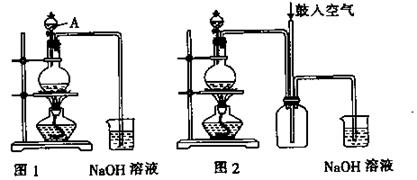
(1)图1烧瓶中发生的反应的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有:
① ;
② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3-4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,晶体采用酒精淋洗的优点是 。
④上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 、
、
。
(1)Cu+4 H++2NO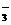
Cu2++2NO2↑+2H2O
或3Cu+8H++2NO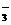
3Cu2++2NO↑+4H2O (2分)
(Cu+4H++2NO2=Cu2++2NP2↑|+2H2O也可)
(2)防止倒吸(1分) 有害气体能被完全吸收(1分)
(3)①坩埚(1分)②b(1分)③防止双氧水分解(1分)酒精与水互溶且极易挥发,减少晶体溶解(1分)④第二组(1分) 第一组方案1需要灼烧,多消耗能源(1分);第一组方案2所得产品含有铁元素杂质(1分);而第二组方案几乎不产生有害气体,且所得产品纯度较高(1分)
7.(08扬州中学)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生改进后的装置:
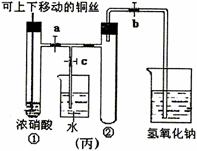
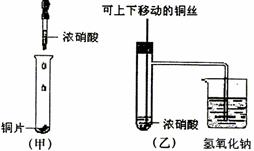
(1)写出铜和浓硝酸反应的化学方程式 。
(2)和甲装置相比,乙装置的优点 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是 (标况)。
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (3分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(4分)
(3)关闭c;打开a、b。(4分)
(4)先关闭b,再关闭a, 然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分) (4分)
(5)1/22.4mol·L-1或0.045mol·L-1 (3分)
6.(08泰州)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
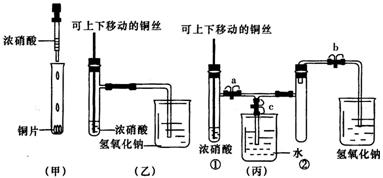
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是
(2)和甲装置相比,乙装置的优点是 ① ;② 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满试管②。
(4)当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进人试管②应如何操作?
(1)Cu+4HNO3 = Cu( NO3)2+ 2NO2↑+2H2O。(2分)
(2)①可以控制反应; (1分) ②吸收NO2气体,防止污染环境 。(1分)
(3)c ,(1分) a、b ,(1分)
(4)先关闭b,再关闭a,然后打开c,(1分) 用手捂住(热水、热毛巾、加热)试管②。(合理答案均给分)(1分)
5.(08启东中学)中学教材高中化学第一册有如图3所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图4所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:
①、首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
②、向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
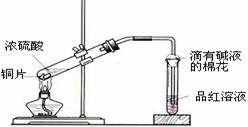
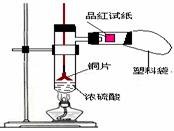
图3 图4
回答下列问题:
(1)如图4所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可 进 行 的 操 作是:
相关的离子方程式是: 。
解析:当铜片接触热浓硫酸时,有大量的白雾产生(白雾是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿,当品红试纸完全褪成白色后,把铜片向上提使其离开浓硫酸溶液,反应马上停止。
答案:(1)支管口有白雾,试管中出现绿色,品红试纸褪色,铜片部分溶解。(回答出一个给1分,满分3分);
(2)收集多余的SO2气体,防止污染空气;(3分)
(3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体 (2分)
SO2+2OH-=H2O+SO32-或SO2+OH-=HSO3-(3分)
评注:本题是考查实验装置的改进,源于教材而又高于教材,通过改进后,实验现象更明显,而且还符合环保,要求考生能了解各个装置图在实验中所取的作用,装置图读准确了,做题也就简单了。考纲明确提出出值得引起大家的重视。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com