
题目列表(包括答案和解析)
5.(2008年苏州一模)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7,标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
 Cr2O72-+
Cr2O72-+ Fe2++
Fe2++ H+=
H+= Cr3++
Cr3++ Fe3++
Fe3++ H2O
H2O
(1)请配平第二道离子方程式(将化学计量数直接填入方框内)
(2)求样品中FeS2的质量分数(假设杂质不参加反应)。
(3)煅烧10 t上述黄铁矿,则理论上产生标准状况下的SO2的体积为多少升?可制得98%的硫酸质量多少吨?
(1)1、6、14=2、6、7;(2)90.00%(3分);(3)3.4×106 15
6(08无锡模拟)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的S02气体与足量Fe2(S04)3溶液完全反应后,用浓度为0.0200 mol·L-1的K2Cr207,标准溶液滴定至终点,消耗K2Cr207溶液25.00 mL。
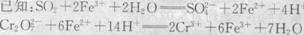
(1)求样品中FeS2的质量分数(假设杂质不参加反应)。
(2)煅烧10 t上述黄铁矿,则理论上产生标准状况下的S02的体积为多少升?可制得98%的硫酸质量多少吨?
4. ⑴ 漏斗、玻璃棒、烧杯
低温蒸发结晶 ⑵ (如图或其
⑴ 漏斗、玻璃棒、烧杯
低温蒸发结晶 ⑵ (如图或其
他能防止氨气倒吸的装置) ⑶ 冷凝管
⑷ ① 吸水
 ② 2CaSO4
2CaO+2SO2↑+O2↑
② 2CaSO4
2CaO+2SO2↑+O2↑
③ 75.6%
(第⑴小题每空1分,其余每空2分。本题共12分)
14.(12分)最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:
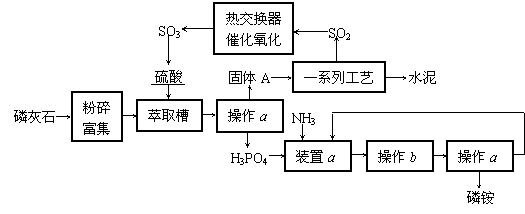
回答下列问题:
⑴ 若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有 ▲ ;进行操作b时需注意 ▲ 。
 ⑵
装置a用于磷酸吸收NH3。若该过程在实验室中进行,请在下面的方框内画出装置a的示意图。
⑵
装置a用于磷酸吸收NH3。若该过程在实验室中进行,请在下面的方框内画出装置a的示意图。
⑶ 热交换器是实现冷热交换的装置。化学实验中也经常
利用热交换来实现某种实验目的,如气、液热交换时通常
使用的仪器是 ▲ 。
⑷ 固体A为生石膏(CaSO4·2H2O)和不含结晶水且高
温时也不分解的杂质。生石膏在120℃时失水生成熟石膏
(2CaSO4·H2O),熟石膏在200℃时失水生成硫酸钙。
为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180g置于坩埚中加热,加热过程中固体质量随温度变化记录如下图:
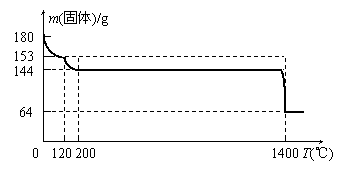 ①
实验中每次对固体称量时须
①
实验中每次对固体称量时须
在冷却后进行。为保证实验结
果的精确性,固体冷却时必须
防止 ▲ 。
②将加热到1400℃时生成的气
体通入品红溶液中,品红褪色。
写出1400℃时的化学反应方程
式 ▲ 。
③ 固体A中生石膏的质量百分
含量= ▲ 。
20.(共7分)
(1)78.4%(2分)
设生成8 L SO2,则原空气为11×1.2=13.2(L),反应后混合气体积为10.2 L。
SO2%=8/10.2=78.4%
(2)①b=0.5a+8(3分) ②b=11(1分),b=10.7 即:32/3(1分)
3.(08金陵、海安联考)硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃-900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
① 3FeS2+8O2→Fe3O4+6SO2 ② 4FeS2+11O2→2Fe2O3+8SO2
(1)为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,所得炉气中SO2的体积分数为多少?
(2)480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe)∶n(O)=4∶a,此时消耗氧气为b mol。
①试写出b与a的关系式:_____________________________。
②b的最大值为____________,最小值为_____________。
2.(1)黄铁矿为原料的生产中产生的废弃物太多,处理成本高(2分)
(2)C、D(2分)
(3)①净化气体 ②控制温度在400-500℃ ③增大催化剂与反应气体的接触面积(3分)
(4)①<(1分),在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热 量小于196kJ (2分)
(5)93.4% (3分)(6) 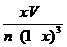 (2分)
(2分)
2.(08茂名市二模)工业制硫酸生产流程如下图:
|
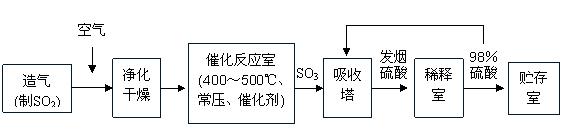

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是 (2分)(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 (2分)
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
(3)在生产中,为提高催化剂效率采取了哪些措施?
(3分)
(4)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。 (3分)
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。 (3分)
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为 (3分)
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。(2分)
1.(10分)(08启东中学信息卷)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,煅烧、催化氧化、吸收。请回答下列个问题:
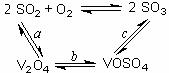 (1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入____________(填设备名称),其主要目的是_______________________________。
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入____________(填设备名称),其主要目的是_______________________________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中a、c二步的化学方程式可表示为:________________________________________、
____________________________________________________。
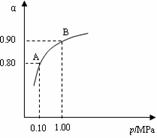 (3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。则:将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于_______________。A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是________________________________________________。
(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。则:将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于_______________。A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是________________________________________________。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。
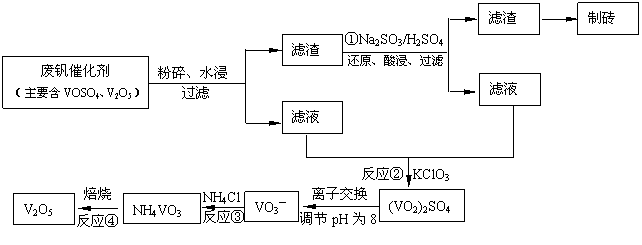
 则:反应①②③④中属于氧化还原反应的是
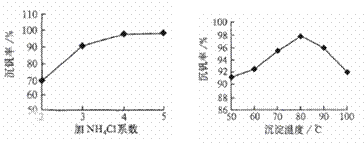
(填数字序号),反应①的离子方程式为______________________________________。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度:_____、______。
则:反应①②③④中属于氧化还原反应的是
(填数字序号),反应①的离子方程式为______________________________________。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度:_____、______。
(1)接触室,防止催化剂中毒。(各1分,共2分)
(2)SO2+V2O5 SO3+ V2O4 4VOSO4+O2
SO3+ V2O4 4VOSO4+O2 2V2O5+4SO3(各1分,共2分)
2V2O5+4SO3(各1分,共2分)
(3)400 L·mol-1,使用常压SO2就可以达到较高的转化率。(前者2分,后者1分,共3分)
(4)①②,V2O5+ SO32-+4H+=2VO2++SO42-+2H2O。4和80℃。(各1分,共3分)
6.[答案](12分)
(1)否 硫酸溶质质量分数为23%<60%,其氧化性不突出所以无明显现象(2分)
(2)铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色。(2分)
(3)现象是: 液体无色或浅蓝色,有白色固体在试管底部析出。(2分)
原因:98%浓H2SO4有吸水性只剩无水硫酸铜。(2分)
待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌。(2分)
(4)Cu2S或硫化铜或Cu2S与硫化铜的混合物(2分)
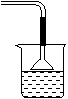
12.(12分)下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol·L-1,密度为1.84g·cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10-15滴(约0.5mL),加热至沸腾,该试管中液体是否有有明显变化______
___。试用数据解释原因___________________。
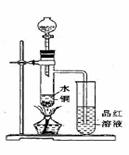
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是______________。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 __________________原因是__________________________________。为了最终看到与甲类似的现象,乙同学需进行的操作是___________________。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com