
题目列表(包括答案和解析)
30.有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出24mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的pH(设体积可以加和)
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
29.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
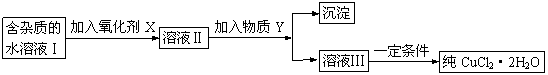
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)除去Fe3+的有关离子方程式是(物质Y在(2)中选择合适的选项):
________________________________________________________________________
(4)加入氧化剂的目的是____________________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)________________________________________________。
28.(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c [Na+] > c [CN-],用“>、<、=”符号填空
①溶液中c [OH -] c [H +] ②c [HCN] c [CN-]
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(4)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
27.我们知道空气中含有N2、O2、CO2、H2S等气体。分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到显现浅红色在半分钟内不褪色为终点。约半分钟后导致褪色的原因:__________ ________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2===S4O62-+2I-),到蓝色恰好褪去为终点,约5min后溶液又显色的原因:_____ ___________。
(3)以紫色KMnO4为标准溶液滴定还原剂,在消耗完还原剂后,再多加0.5-1滴KMnO4溶液后呈现的浅红色在半分钟内不褪色为终点。约半分钟后浅红色褪色的可能原因:__________________ 。
26.相同条件,等物质的量浓度的下列八种溶液:①Na2CO3,②NaClO,③NaAc,④Na2SO4,⑤NaHCO3 ,⑥NaOH ,⑦(NH4)2SO4 ,⑧NaHSO4等溶液,PH值由大到小的顺序为:
25.我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
 反应Ⅰ HgS
+O2 Hg +SO2
反应Ⅰ HgS
+O2 Hg +SO2
 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列:
(1)HgS与氧气反应,氧化剂是 。
(2)请标出反应Ⅱ中电子转移的方向和数目。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+  Hg22+ ,提高Hg22+浓度的方法是:
。
Hg22+ ,提高Hg22+浓度的方法是:
。
24. 25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=y,则x值为
25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=y,则x值为
A.2 B.3 C.4 D.5
23.已知酸H2B在水溶液中存在下列关系:①H2B = H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na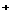 )+c(H
)+c(H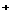 )= c(HB
)= c(HB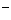 )+c(OH
)+c(OH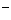 )+c(B
)+c(B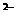 )
)
D.在Na2B溶液中一定有:c(OH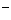 )=c(H
)=c(H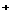 )+c(HB
)+c(HB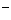 )
)
22.从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)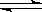 H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
A.红色变深 B.黄色变浅 C.黄色变深 D.褪为无色
21.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)= c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在:c(Na’)> c(OH-)> c(A-)> c(H+)
D.若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com