
题目列表(包括答案和解析)
10、常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A、pH > 7,且c(OH-) > c(Na+) > c(H+) > c(CH3COO-)
B、pH > 7,且c(Na+) + c(H+) = c(OH-) + c(CH3COO-)
C、pH < 7,且c(CH3COO-) >c(H+) > c(Na+) > c(OH-)
D、pH = 7,且c(CH3COO-) > c(Na+) > c(H+) = c(OH-)
9、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A、100 mL 1 mol·L-1 FeCl3溶液中含阳离子数为0.1 NA
B、1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023
C、0.6gCaCO3与Mg3N2的混合物中所含质子数为0.3 NA
D、T℃时,1 L pH=6纯水中,含10-6NA个OH-
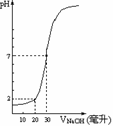
8、下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是
|
|
A |
B |
C |
D |
|
C(HCl)(moL/L) |
0.12 |
0.04 |
0.18 |
0.09 |
|
C(NaOH)(moL/L) |
0.04 |
0.12 |
0.06 |
0.03 |
7、一定温度下,在体积为VL的密闭容器中加入1 molX和1 molY进行如下反应: X(g)+Y(g) 2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
A、向平衡混合物中加入少量W,正、逆反应速率均增大
B、平衡后加入X,上述反应的△H增大
C、温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的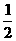
 D、当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
D、当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
6、一定温度下,在一容积固定的密闭容器中建立了如下平衡:2A(g)→ B(g),保持温度不变,若再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器A的体积分数比原平衡时
A、都减小 B、都增大 C、前者增大,后者减小 D、前者减小,后者增大
5、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大。相同条件下等体积等浓度的HCN溶液和HClO溶液相比较,下列说法正确的是
A、电离程度:HCN>HClO B、与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
C、pH:HClO>HCN D、酸根离子浓度: c(CN-)< c(ClO-)
4、下列关于电解质的有关叙说正确的是
A、电解质溶液的浓度越大,其导电性能一定越强
B、强酸和强碱一定是强电解质,不管其水溶液浓度的大小,能完全电离
C、强极性共价化合物不一定都是强电解质。
D、多元酸、多元碱的导电性一定比一元酸、一元碱的导电能力强
3、在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A、1∶9 B、1∶1 C、1∶2 D、1∶4
2、某学生交给老师的实验报告上有以下四个数据: ①用量筒量取5.13mL 盐酸;②用托盘天平称取11.7g氯化钠固体;③有广泛PH试纸(PH值由1--14)测得某溶液的PH值为2.2;④在中和滴定时,用取氢氧化钠溶液的体积为21.82 mL。其中测量数据合理的是 A、①② B、②④ C、①③ D、①④
1、用PH试纸测定某弱酸的PH值,如果先将PH试纸用蒸馏水润湿后,再把待测液滴到PH试纸上,跟比色卡对照,溶液的PH值为5,则该弱酸溶液的实际PH值
A、大于5 B、小于5 C、等于5 D、大于7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com