
题目列表(包括答案和解析)
20、(每格2分,共8分)对可逆反应aA(g)+bB(g) cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: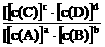 =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
19、(每格2分共10分)温度为TK,压强为PkPa时,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压,发生反应A(g)+B(g) 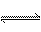 C(g) 达到平衡时,C的体积分数为20%,试回答:
C(g) 达到平衡时,C的体积分数为20%,试回答:
(1)上述反应达到平衡时,容器的容积为______________
(2)若使温度和压强在上述条件下恒定不变,密闭容器中只充入2molA和2molB,当达到新平衡时,容器的容积为______________,C的体积分数为_______________
(3)若另选一容积不变的密闭容器,仍保持温度为TK,使3molA和3molB反应达到平衡时,C的体积分数仍为20%,则所选密闭容器的体积应为____________
(4)若在上述条件下,保持容器的容积不变,使温度升高为2TK,达到平衡时,C的体积分数为18%,则该反应的正反应为____________热反应(填“放”或“吸”)
18、(每格2分,共12分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白。
⑴若溶液中只溶解了一种溶质,则该溶质是_____________,上述四种离子浓度的大小顺序为______________(填序号)。
⑵若上述关系中③是正确的,则溶液中的溶质为________________________;若上述关系中④是正确的,则溶液中的溶质为________________________
⑶若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系
c(H+)________c(OH-)。
17、(每格2分,共8分)(1)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1MOH的溶液等体积混合(忽略混合后溶液体积的变化),测得混合液的pH=6,试回答以下问题:
①混合溶液中水电离出的C(H+)_____0.2mol·L-1HCl溶液中水电离出的C(H+); (填“<”“=”或“>”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)=________mol·L-1
c(H+)-c(MOH)=________mol·L-1
(2)室温下如果取0.2mol·L-1 MOH溶液与0.1mol·L-1HCl溶液等体积混合,测得混合液的pH<7,则说明MOH的电离程度_______MCl的水解程度。 (填“<”“=”或“>”)
16、(每格2分,共12分)一刚性容器内部有一个不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的N2气体,右室充入A和B两种气体,且A和B的物质的量之比为3:2,右室内发生如下反应:3A(g)+2B(g)  C(g)。反应开始前活塞停留在离左端1/4处(如图),反应在恒温下进行,当反应达平衡状态时,活塞处于容器中间。
C(g)。反应开始前活塞停留在离左端1/4处(如图),反应在恒温下进行,当反应达平衡状态时,活塞处于容器中间。
0 1 2 3 4
|
N2 |

|
试回答下列问题:
①右室气体反应前后的压强之比为 ,物质的量之比为 。
②反应达平衡时气体A的转化率为 。
③原容器中左右两室起始时充入的各物质的量均为原来的两倍,那反应前活塞相对于原来的1/4处将 (填“偏左”、“偏右”或“不变”),达平衡时,活塞相对于中间位置将 (填“偏左”、“偏右”或“不变”)。A的转化率将 (填“变大”、“变小”或“不变”)
15、(每格2分,共10分)某学生用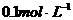 的
的 标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A. 移取 待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B. 用标准溶液润洗滴定管2-3次
C. 把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D. 取标准 溶液注入碱式滴定管至刻度0以上2-3厘米
溶液注入碱式滴定管至刻度0以上2-3厘米
E. 调节液面至0或0以下刻度,记下读数
F. 把锥形瓶放在滴定管的下面,用标准 溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_______________________。
(2)上述B步骤操作的目的是____________________。
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是________________________________________。
(4)判断到达滴定终点的实验现象是___________________________。
(5)若称量一定量的 固体(含少量
固体(含少量 )配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是_________________________________________。
)配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是_________________________________________。
14、在常温下10ml pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A、c(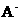 )<c(
)<c(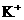 )
B、c(
)
B、c(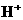 )=c(
)=c( )<c(
)<c(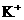 )=c(
)=c(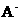 )
)
C、 ≥20ml
D、
≥20ml
D、 ≤20ml
≤20ml
第Ⅱ卷(非选择题,共72分)
13、某二元酸(H2A)按下式发生电离:H2A
= H++HA-;HA- H++A2-。关于下列四种
H++A2-。关于下列四种
溶液的说法正确的是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A、四种溶液中c(HA-)浓度大小:③>①>②>④ B、溶液①中一定不存在OH-
 C、溶液②中存在水解平衡:HA-+H2O H2A+OH-
C、溶液②中存在水解平衡:HA-+H2O H2A+OH-
D、溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
12、对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A、加入适量的氯化铵晶体后,两溶液的pH均碱小
B、温度下降10oC,两溶液的pH均不变
C、分别加水稀释10倍,两溶液的pH仍相等
D、用盐酸中和,消耗的盐酸体积相同
11、将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+Y(g)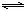 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是
A、升高温度,X的体积分数增大
B、增大压强,Z的浓度不变
C、保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D、保持容器体积不变,充入一定量的Z,X的体积分数增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com