
题目列表(包括答案和解析)
0.05mol·L-1的Ba(OH)2溶液的pH= 。
(2)已知25℃时,0.1L0.1mol·L-1的NaA溶液的pH=10,则NaA溶液中
所存在的化学平衡有(用离子方程式表示): 。
溶液中各离子的物质的量浓度由大到小的顺序为_______________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所
得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___________。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强碱的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为:pH(酸)+pH(碱)=_______________。
17.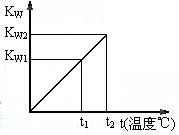 (12分)水的离子积常数KW与温度t(℃)的关系如右图所示:
(12分)水的离子积常数KW与温度t(℃)的关系如右图所示:
(1)若t1=25℃,则KW1=_______;若t2=100℃时,KW2=10-12,则
16.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是( )
A.6g B.8g C.10g D.12g
15.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
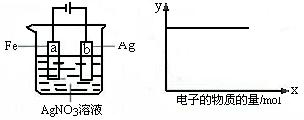
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
14.常温时,将V1mL c1mol/L的氨水滴加到V2mL c2mol/L的盐酸中,下叙结论中正确的是
A.在V1=V2,c1=c2,则混合液中c(NH4+)>c(Cl-)
B.若混合液的pH=7,则混合液中c(NH4+) = c(Cl-)
C.若V1=V2,且混合液的pH<7,则一定有c1<c2
D.若混合液的pH=7,则c1V1=c2V2
13.某同学为证明NaOH溶液能使酚酞试液变红是OH-的性质,他所设计的下列实验中没有意义是( )
A.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaCl溶液与酚酞试液作用,观察溶液颜色
C.测定NaOH的溶解度,证明其易溶于水,并观察溶液的颜色
D.向滴有酚酞的NaOH溶液中加入盐酸,观察溶液的颜色
12.在一定条件下,固定容积的密闭容器中反应:2NO2(g) 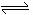 2NO(g)
+ O2(g) ;△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
2NO(g)
+ O2(g) ;△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A.当X表示温度时,Y表示NO的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示向容器中充入气体Ne的物质的量时,Y表示NO的物质的量
11.下列离子方程式书写正确的是
 A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO42- =BaSO4↓ + NH3·H2O + H2O
B.硫化钠溶液中滴入稀硝酸:S2- + 2H+ = H2S↑
C.用Pt电极电解MgCl2溶液:2Cl- + 2H2O  Cl2↑+ H2↑+ 2OH-
Cl2↑+ H2↑+ 2OH-
D.K2CO3溶于水:CO32-+H2O = HCO3- + OH-
10.下列各组离子一定能大量共存的是
A.在强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32-
B.在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
C.在c(H+)=10-13mol·l-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
9.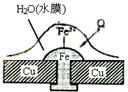 铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是
铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是
A.此过程中铜并不被腐蚀
B.此过程中还涉及到反应:4Fe(OH)2 +2H2O +O2 == 4Fe(OH)3
C.正极电极反应式为:2H+ + 2e- → H2↑
D.此过程中电子从Fe移向Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com