
题目列表(包括答案和解析)
7.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是 ( )
A.标准状况下,3.01×1023个CCl4所占的体积约为11.2 L
B.80 g NH4NO3晶体中约含有NH4+ 6.02×1023个
C.3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022
D.46 g NO2和N2O4混合气体中含有原子数约为1.806×1024
5.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是:
O2+4H++4e-=2H2O。下列叙述中不正确的是( )
A.电池的总反应是:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+
C.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入。
D.电池工作时,H+由正极移向负极
|
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4· Cr2(SO4)3
Cr2(SO4)3
4.下列实验操作中,正确的是 ( )
①用托盘天平称取5.2 g NaCl
②用50 mL 量筒量取5.2mL盐酸
③用蒸发皿加热NaCl溶液可以得到NaCl晶体
④用100 mL容量瓶配制50 mL 0.1mol•L-1 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3 ⑥中和热测定的实验中使用的玻璃仪器只有2种
A.①③⑤ B.②④⑥ C.①③⑥ D. ③④⑤
3.氕化锂、氘化锂、氚化锂可以作为长征2号火箭发射的重要燃料,下列说法正确的是
A.H、D、T之间互称同素异形体 B.氕化锂、氘化锂、氚化锂起催化剂作用
C.LiH、LiD、LiT的摩尔质量之比为1﹕2﹕3 D.它们都是强还原剂
2.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是 (
)
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是 (
)
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
21.(8分)铜是重要的工业原材料,现有Cu、Cu2O、CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入1L0.6mol·L-1HNO3溶液刚好使其溶解,同时收集到2.24LNO气体(标准状况)。通过计算回答下列问题(写出解题过程)
(1)产物中硝酸铜的物质的量。
(2)如混合物中Cu的物质的量为x,则x的取值范围为
20.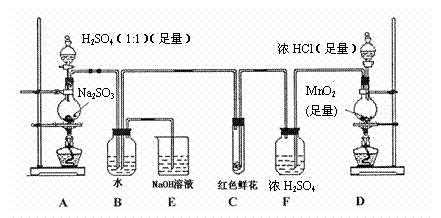 (12分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
(12分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、 。
(2)实验开始后,写出B中反应的离子方程式 。
 (3)C中的现象是
,E装置的作用是
。
(3)C中的现象是
,E装置的作用是
。
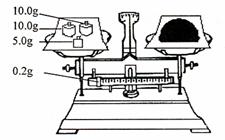
(4)按右图所示称取一定量的Na2SO3样品放入A装置的烧
瓶中,滴入足量的H2SO4完全反应。然后将B中完全反
应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,
得白色沉淀23.3g,则原样品中Na2SO3的纯度为
(精确到0.1%)。
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复操作,若
该学生没有重复过滤,则测定的结果将 (填
“偏高”、“偏低”或“无影响”)。
19.(8分)如图所示

某容器分隔成A、B两部分,A容积固定不变,B有可移动的活塞,现在A中通入2molSO2和1molO2,在B中通入2molSO3和1molN2,在相同温度下均发生反应:2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
请根据下列要求填写空白:
(1)如果活塞位于3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA和PB的关系是PA______PB(填“<”、“>”或“=”)
(2)若要使A中与B中平衡状态相同,活塞左端应处于刻度________处。
(3)若活塞左端移到刻度5处,达平衡后,B中SO3为xmol,A中SO3为ymol,则x和y关系为x y(填“<”“>”或“=”)。理由是: 。
18.(12分)(1)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:
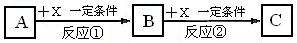
①若X是强氧化性单质,则A不可能是________。
a. S b. N2 c. Na d. Mg
②若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为_____________________________;C溶液在贮存时应加入少量X,理由是(用必要的离子方程式表示)____________________________________,检验此C溶液中金属元素价态的操作方法是___________________________________。
(2)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物:Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
①Z2Y的化学式是___________________________。
②Z2Y2与X2Y反应的化学方程式是:__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com