
题目列表(包括答案和解析)
2.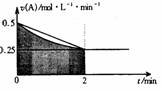 某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
A.图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
1.在恒温恒容条件下,将4molA和2molB放入一密闭容器中发生反应:2A(g)+B(g) 2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
A.4mol、2mol、0mol、2mol B.2mol、1mol、2mol、2mol
C.2mol、1mol、2mol、1mol D.2mol、1mol、0mol、1mol
16.(12分)将一定量的铝和过氧化钠混和物投入一盛有20mL蒸馏水的烧杯中,反应终止时得一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少3.5g,再向所得溶液中滴加3.5mol/L盐酸直至产生的沉淀刚好溶解,消耗盐酸200mL。求原混和物中Al和Na2O2各多少g?
15.(14分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量 /g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
35 |
54 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
__________________________________________________________________________________。
13.(10分)原子序数依次增大的A、B、C、D、E、F六种短周期元素①原子半径由大到小顺序是D>E>F>B>C>A②E是同周期中离子半径最小的元素,F是同周期中原子半径最小的元素③B的最高价氧化物的水化物和氢化物反应生成盐④C和D可以形成1:1和1:2的两种常见化合物。
回答:
①C和D生成1:1的化合物的电子式: 。
②E的最高价氧化物水化物和B的最高价氧化物的水化物反应的离子方程式
③F的单质和强碱反应的离子方程式为
④A、C、D、E、F的简单离子的半径由大到小的顺序是(用元素的离子符号表示)
⑤用离子方程式说明B与A形成的氢化物结合H+能力强于C与A形成的氢化物:
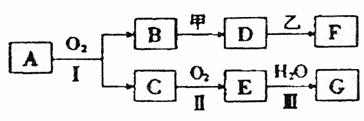 14.(16分)物质间的转化关系如图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中反应和生成物未全部给出,反应条件也未注明。
14.(16分)物质间的转化关系如图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中反应和生成物未全部给出,反应条件也未注明。
(1)若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为淡黄色的固体,D、F的溶液均呈碱性。则:
①1.7g A与O2反应生成气态的B和C时放出22.67kJ的热量,写出该反应的热化学方程式:
②写出化学式:甲 、F 。
(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①写出II的化学方程式 ;
工业上实现该反应是在 (填设备名称)中进行的。
②完成I的化学方程式并用单线桥表示电子转移方向和数目:
。
③完成B→D反应的离子方程式:
④写出检验F中所含阳离子的试剂 。
12.关于下列各装置图的叙述中,不正确的是
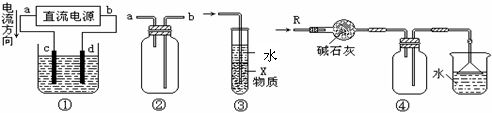
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.某温度下,在一容积可变的恒压密闭容器里,反应3A(g)  B(g) + 3C(g)达到平衡时, A、B和C的物质的量分别为6mol、2mol、6mol。在保持温度和压强不变的条件下,下列说法正确的是( )
B(g) + 3C(g)达到平衡时, A、B和C的物质的量分别为6mol、2mol、6mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.加入一定量的A气体达平衡后,C的百分含量一定增加
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.将A、B、C各减少1 mol,A的百分含量增加
D.充入1 mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
10.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Na+、K+、NO3-、SO42- B.K+、ClO-、Cl-、NO3-
C.Ca2+、AlO2-、SO42-、Cl- D. NH4+、Na+、F-、CO32-
9.下列离子方程式书写正确的是 ( )
A.向CaCl2溶液中通入少量CO2气体: Ca2++CO2+H2O=CaCO3↓+2H+
B.碳酸钠溶液与硫酸氢钠溶液反应: HCO3-+H+=CO2↑+H2O
C.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
D.含有FeBr2溶液中通入足量的Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
8.下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1molBa(OH)2的稀溶液和含1molH2SO4的稀溶液反应释放热量a KJ,则表示该反应中和热的热化学反应方程式为:Ba2+(aq) + 2OH-(aq) + 2H+(aq) + SO42-(aq)=2H2O(l) + BaSO4(s);△H= -a KJ/mol
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com