
题目列表(包括答案和解析)
8.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
7.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子质量为
A.73.3 B.73 C.74 D.70.6
6.实验室用白磷(P4)和四碘化二磷(P2I4)与水共同反应来制备碘化鏻(PH4I)。同时还生成磷酸,下面叙述正确的是
A.方程式中P2I4和PH4I的系数比为1:4 B.水在反应中为氧化剂
C.生成的磷酸是还原产物 D.反应过程中无电子得失和偏移
5.已知H2O(g)=H2O(l);△H1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3) C.1.5Q1+0.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
4.化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
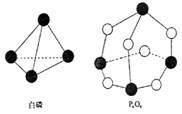 化学键时释放(或吸收)出的能量。已知白磷和P4O6的
化学键时释放(或吸收)出的能量。已知白磷和P4O6的
分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)
P-P:198 , P-O:360 , O2分子:498 。则反应
P4(白磷)+3O2→P4O6的反应热△H为
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
3.下列反应中,Na2O2既不是氧化剂又不是还原剂的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑
C.Na2O2+H2SO4=Na2SO4+H2O2 D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
2.要配制下列含有较多量不同阴、阳离子的四种溶液,其中能配制成功的是
A.K+、Al3+、Cl-、CO32- B.H +、Zn2+、S2O32-、Cl-
C.H +、SO32-、S2-、Cl- D.Mg2+、SO42-、NH4+、Cl-
1.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2NaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.3S+6KOH=2K2S+K2SO3+3H2O D.NH4Cl+NaNO2=NaCl+N2↑+2H2O
14.(15分)向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如右图,试回答:
⑴a点之前的反应的离子方程式为: ;
⑵a点到b点之间的反应离子方程式是: ;
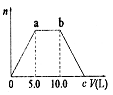 ;
;
⑶c点的二氧化碳体积是 L
⑷混合稀溶液中Ba(OH)2和NaOH的物质的量之比为 。
(以上计算题请写出必要的计算过程)
13.(6分)已知下列两个热化学方程式;
H2(g)+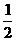 O2(g)===H2O(1);△H=-285.kJ/mol
O2(g)===H2O(1);△H=-285.kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
⑴实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
⑵已知:H2O(1)=H2O(g);△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com