
题目列表(包括答案和解析)
1、氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A、一个D2O分子所含中子数为8
B.NH3的结构式为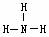
C.HCl的电子式为 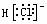 D.热稳定性:HCl>HF
D.热稳定性:HCl>HF
25、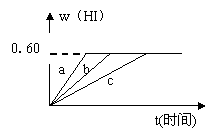 将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);ΔH>0,并达平衡。
2HI(g);ΔH>0,并达平衡。
HI的体积分数w(HI)随时间变化如图曲线b所示:
(1)达平衡时,I2(g)的物质的量浓度为___________。
(2)若改变反应条件,
在甲条件下,w(HI)的变化如图曲线a所示,
在乙条件下,w(HI)的变化如图曲线c所示。
则甲条件可能是__________;乙条件可能是___________。(填入下列序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________ ___。
24、(8分)根据下表数据,请回答下列问题:
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
⑴ 比较下列两组物质的熔点高低 (填>或<= SiC______ Si; SiCl4 ______ SiO2
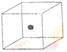 ⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) +
4HCl(g) 该反应的反应热△H = _________ KJ/mol
Si(s) +
4HCl(g) 该反应的反应热△H = _________ KJ/mol
23、(12分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件判断出符合题意的元素,请写出相应的元素名称:
A________、B_______、C______、D_______、E_______、F______。
⑵画出B的原子结构示意图:________ ___。(3)写出C单质与A的最高价氧化物的水化物的水溶液反应的离子方程式:
(4)若1 mol F单质与C的单质恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物的水化物反应,消耗_________ mol A的最高价氧化物的水化物。
22、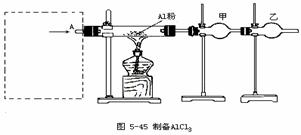 (15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
(15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:
(1)利用上述条件,可制取的气体有(填化学式) ____ __;
(2)若要安全、顺利地制取无水氯化铝,通入A口的气体应是 ______;
(3)用中学化学实验室常用的方法制取通入A口的气体的反应方程式是___ ___
(4)用(3)的方法制得的气体中可能还含有的气体有 ___ ___,通入A口前是否有必要除去,不必除去或必须除去的原因是____ __;
(5)按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有_____ _;
(6)装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)______,甲的作用是____ __,乙的作用是___ ___。
21、(12分)设计证明CH3COOH为弱酸的实验方案。(可不填满,若不够时可自行添加)
|
序号 |
实验原理 |
实验操作 |
实验结论 |
|
方 案 1 |
|
|
|
|
方 案 2 |
|
|
|
|
方 案 3 |
|
|
|
|
方 案 4 |
|
|
|
20、(12分)一定温度下,发生反应:N2(g)+3H2(g)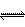 2NH3(g)△H<0
2NH3(g)△H<0
(1)若在相同温度下,1mol N2和3mol H2 分别在恒压密闭容器A中和恒容密闭容器B中反应,开始时A、B的体积相同。则 容器中先达到平衡; 容器中的N2的转化率高
(2)当A中已达到平衡时,再加入1摩Ar,则N2的转化率 ;正反应速率会
(3)若B中反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为a、b、c摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使达到平衡后N2、H2、NH3的物质的量也为a、b、c摩。则应满足的条件是:
①若x=0,y=0,则z=
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是
19.(4分)有两个起始体积相同的密闭容器A和B,A容器中有一个可自由移动的活塞,能使该容器内始终保持恒压,B容器为固定体积的容器。起始时向这两个容器内分别充入等量的体积比为2 :1的SO2和O2的混合气体,并使A、B两容器的体积相等。在保持400℃的合成条件下,使如下反应:2SO2+O2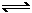 2SO3达到平衡。请回答:
2SO3达到平衡。请回答:
(1)达到平衡所用的时间A容器比B容器 ,两容器中SO2的转化率A比B ___ 。
(2)达到(1)所述的平衡后,若向两容器内通入等量的原反应混合气,则重新达到平衡后,A容器中SO3的百分含量 ;B容器中SO3的百分含量 (增大、减小、不变)。
18、下列溶液,不一定呈中性的是
A.C(H+)=1×10- 7mol·L-1的溶液 B.pH=14-pOH的溶液
C.C(H+)=C(OH-)=1×10-6mol·L-1的溶液 D.pH= pOH的溶液
将选择题答案填入下表:
17、两个硫酸分子可以脱去一分子水生成焦硫酸(H2S2O7)。已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是
A、 4 B、 6 C 、 7 D、 8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com