
题目列表(包括答案和解析)
5.在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是:
①滴有石蕊的CO2溶液 ②滴有石蕊的NH4Cl溶液 ③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液 ⑤滴有酚酞的氢氧化钠溶液 ⑥滴有酚酞的饱和氢氧化钙溶液
⑦滴有酚酞的Na2CO3溶液 ⑧Fe (SCN)3溶液 ⑨溶有SO2的品红溶液
A.④⑥ B.③⑤⑦⑧ C.①④⑥ D.②④⑥⑨
4.下列关于卤素的叙述中正确的是
①卤素的钾盐中,最易被氧化的氟化钾:②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气跟氯化钠水溶液反应,一定有HF和O2生成;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
A.①③⑤ B.②④⑥ C.②⑤⑥ D.①③④
3.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S
两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
1.下列叙述正确的有
(1)电离出的阳离子都是氢离子的一定是酸
(2)晶体中含有阳离子一定含有阴离子
(3)有单质参加或生成的化学反应一定是氧化还原反应
(4)离子化合物中一定含有金属离子
(5)分子晶体中一定含有共价键
(6)强氧化剂与强还原剂一定能发生氧化还原反应
(7)含金属元素的离子一定都是阳离子
(8)检验卤代烃分子的卤元素时,在水解后的溶液中加AgNO3溶液
A.0句 B.1句 C.2句 D.3句
 2.设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用
2.设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用
底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,
可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
28.(14分)环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
① 将2.000L的气体样品通过盛有I2O5固体的加热管,发生的反应为:
5CO + I2O5
 5CO2
+ I2。
5CO2
+ I2。
② 将所产生的碘升华,并加入30.00mL 0.0050 mol·L-1的硫代硫酸钠溶液,发生的反应为:I2 + 2S2O32- = 2I-+ S4O62-
③ 将②中溶液取出 ,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1L该气体样品中有多少毫克(mg)的CO?
27. (12分)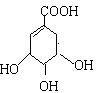 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应的化学方程式是
(有机物用结构简式表示)
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
(4)A在浓硫酸作用下加热可得到B(B的结构简式为HO- -COOH),其反应类型是
。
-COOH),其反应类型是
。
(5)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种同分异构体的结构简式 。
26.(8分)在化学上常用两种模型来表示分子结构,一种是球棍模型,另一种是比例模型。比例模型是用不同颜色球的体积比来表示分子中各种原子的体积。
(1)右图是一种常见有机物的比例模型,该模型图可代表一种( )
 A.饱和一元醇 B.饱和一元醛
A.饱和一元醇 B.饱和一元醛
C.二元酸 D.羟基酸
(2)该物质可发生的反应有( )
A.与H2加成 B.银镜反应
C.消去反应 D.与乙醇酯化
(3)根据(2)中选择,写出该物质发生反应的化学方程式
25.(11分)写出下列反应的离子方程式。
(1)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程都可用“Ba2++SO42-==BaSO4↓”来表示,请写出有关反应的化学方程式(3个)_________________。
(2)溴化碘的分子式为IBr,它跟水反应的化学方程式为H2O+IBr==HBr+HIO,若将其改写成离子方程式应为_________________。
(3)在淀粉KI溶液中加入适量稀硫酸,再滴加少量NaClO溶液,溶液即变蓝色,写出该反应的离子方程式__________________。在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,写出该反应的离子方程式__________________。从以上实验可知ClO-,I2,SO32-的氧化性由强到弱的顺序是_________________________。
24. (10分)下图是部分元素的单质及其化合物的转化关系图(有关反应的条件及部分反应物或生成物已略去);
已知:C、D、F均为单质,其中C、D在常温、常压下是气体;反应②是化工生产中的重要反应,生成物E具有漂白性;J、K均为不溶于水的沉淀,其中J为红褐色。
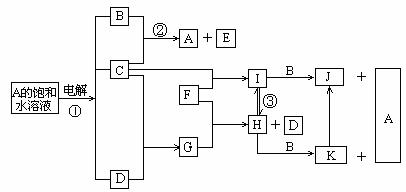
请回答下列问题:
(1)A的电子式:_______________;
(2)反应②的离子方程式是___________________________________;
(3)反应③的化学方程式是____________________________________;
(4)实验室由H制备少量K的方法:是用胶头滴管吸取B溶液,将滴管尖端插入盛有新制H溶液试管底部,慢慢挤出B溶液即可,观察到的现象为:
________________________________________________________;
(5)当有1.12L(标准状况)D生成时,反应①中转移的电子数为___________;
23.(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
 ⑴卤素互化物BrCl能发生下列反应
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。
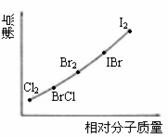
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围是介于 的沸点和 的沸点之间。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com