
题目列表(包括答案和解析)
4.下列有关物质性质的比较中,正确的是
①热稳定性:CH4>NH3>H2O ②还原性: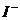 >
>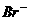 >
>
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
A.①③ B.②④ C.①④ D.②③
3.下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有二套,分别用图1和图2表示。下列选项中正确的是


2.25℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是
A.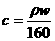 B.
B.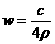 C.
C.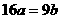 D.
D.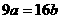
1.下列物质的保存方法正确的是
①少量金属钠保存在冷水中②浓硝酸盛放在无色试剂瓶中③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中⑤氯水存放在带玻璃塞的无色细口瓶中
⑥碳酸钠固体保存在带橡胶塞的细口瓶中
A.②③④ B.③④⑥ C.③④ D.①③④
21.(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
20.(12分)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
19.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
18、(5分)下图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。请按要求填空:
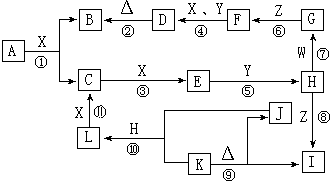
(1)Y、Z的电子式分别为 Y 、Z ;
(2)写出下列反应的化学方程式:
① ;
④ ;
⑨ ;
(3)反应⑩中生成 1molL时,转移的电子数为 。
17.(8分)已知可溶性硫化物在溶液中能与硫单质反应生成可溶性的多硫化物(如Na2Sn)。请回答下列问题:
⑴多硫化物溶于水的电离方程式为 ;
⑵在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同) , ;
⑶在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是 。
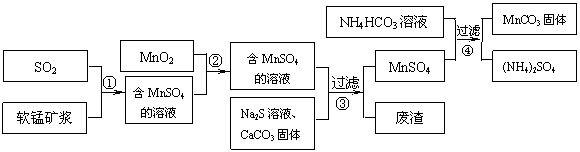
16.(8分)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 ,这样设计的目的和原理是
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com