
题目列表(包括答案和解析)
9、.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是B
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
8、右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。A
挤压胶管的胶头,下列与试验事实不相符的是
A.CO2(NaHCO3溶液)无色喷泉 B.NH3(H2O含酚酞)红色喷泉
C.H2S(CuSO4溶液)黑色喷泉 D.HCl(AgNO3溶液)白色喷泉
7、下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是A
A.F2、K、HCl B.Cl2、Al、H2
 C.NO2、Na、Br2 D.O2、SO2、H2O
C.NO2、Na、Br2 D.O2、SO2、H2O
6、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为A
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
21.白色粉末A由Na2S、Na2S03、Na2S04和NaCl等物质中的三种混合而成,取一定A样品,投入100mL 2.2mol/L盐酸中,充分反应后过滤,最终得到100mL含H+的物质的量浓度为1mol/L的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式 。
(2)A中是否有NaCl (填“有”或“没有”)。
(3)若反应后还生成0.896L(标准状况)气体,且该气体不会使品红溶液褪色。则原取的A样品中含有的各物质的物质的量分别为多少?(要求简单运算)
20.(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上制备无水AlCl3的方法是:将一定粒度的铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按一定配比投入焙烧炉中加热至800℃,再将焙烧过的物料投入到氯化炉中,然后通入Cl2和O2,于950℃在石油焦还原剂的存在下,Al2O3跟Cl2反应,生成气态的AlCl3经冷却后得到氯化铝粗产品(杂质的成分是FeCl3)。尾气中含有大量CO和少量Cl2,用碱液或Na2SO4溶液除去Cl2,并回收CO。精制AlCI3粗产品一般用升华法。在升华器内,加入NaCl固体,同时加入少量某种物质X,将FeCl3杂质还原成Fe作为废渣除去,再经升华就得到精制的AlCl3。回答下列问题:
(1)氯化炉中通入O2的目的是 。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(3)用Na2SO3溶液处理尾气时发生反应的离子方程式是 。
(4)精制AlCl3粗产品时,需加入少量物质X。X可能是下列物质中的 。(填字母)
A.FeCl2固体 B.Fe粉 C.Al粉
(5)精制无水AlCl3合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。试计算该样品中AlCl3的质量分数(写出计算过程)。
19.(10分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
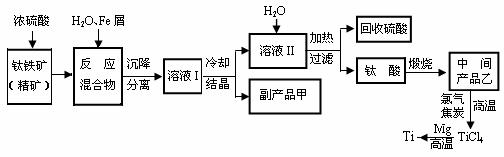 回答下列问题:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
⑵ 上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 。
18.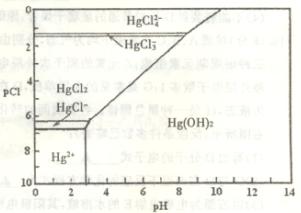 (10分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与
(10分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与 、
、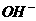 的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(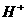 ),pCl=一lgc(
),pCl=一lgc( )]。
)]。
(1)正常海水( 的浓度大于0.1mol/L) 中汞元素的主要存在形态是 。
的浓度大于0.1mol/L) 中汞元素的主要存在形态是 。
少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含 的废水。反应的离子方程式为 。
的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6X10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= 。
17.(10分)下图是工业生产硝酸铵的流程。
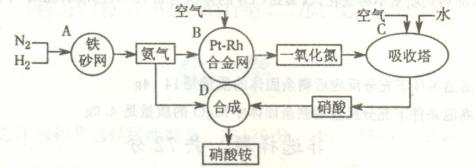
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。
2NH3(g) △H=一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达
到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为 。
16.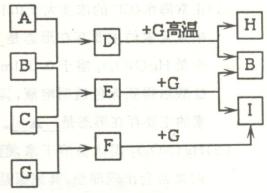 (8分)单质A、B、C在常温下均为气态,分别由X、Y、Z 三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z 三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(1)写出D分子的电子式 。
(2)G与D在高温下反应的化学方程式为 。
(3)以石墨为电极电解E的水溶液,其阳极电极反应式为 。
(4)实验室检验F的水溶液中所含金属阳离子的操作方法、现象和结论是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com