
题目列表(包括答案和解析)
2、将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是 ( )
A. c(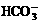 )略大于c(
)略大于c(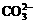 )
)
B. 能使酸性高锰酸钾溶液褪色
C. c(Na+)等于c(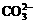 )与c(
)与c(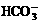 )之和
)之和
D. c(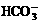 )略小于c(
)略小于c(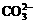 )
)
1、2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是( )
 A.合金的熔点通常比组分金属高,硬度比组分金属小
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5反应冶炼钒,铝作还原剂
D.ETFE膜(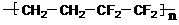 )是由两种
)是由两种
单体缩聚而成的
29、(13分)
某钠盐溶液可能含有阴离子NO ,CO
,CO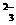 ,SO
,SO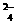 ,Cl
,Cl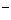 ,Br
,Br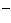 ,I
,I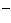 ,为鉴定这些离子-,分别取少量溶液进行以下实验:
,为鉴定这些离子-,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaBl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
⑤加HN03酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①____________________________________________________;
实验②________________________________________________________;
实验③______________________________________________________;
实验④____________________________________________________;
实验⑤________________________________________________________;
(2)上述5个实验不能确定是否存在的离子____________________________。
28、(14分)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
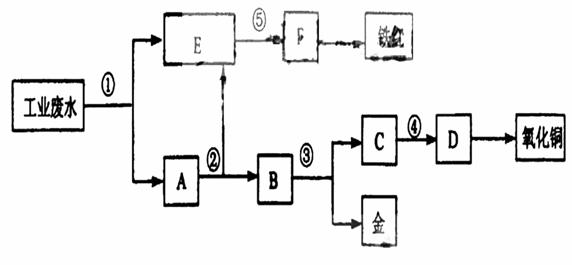
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
27、(15分)
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将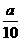 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
26、某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内。

⑵反应中,被还原的元素是 ,还原剂是 。
⑶将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
13、下列离子方程式书写正确的是B
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag++S2-→Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O
12、已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
 A.甲是浓氨水,乙是浓硫酸 C
A.甲是浓氨水,乙是浓硫酸 C
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
11、.已知:H2(g)+F2(g)==2HF(g)+270kJ,下列说法正确的是C
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270Kj
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量
10、设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用
 底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是B
底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是B
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com