
题目列表(包括答案和解析)
19、(10分)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
__C+__K2Cr2O7 +__H2SO4 →__CO2+__K2SO4+__Cr2(SO4)3 +__ H2O
(1) 配平上述反应的化学方程式
(2) 上述反应中氧化剂是______ __(填化学式) 被氧化的元素是____ ____(填元素符号)。
(3) H2SO4 在上述反应中表现出来的性质是____________(填选项编号)
(A) 氧化性 (B) 氧化性和酸性 (C)酸性 (D)还原性和酸性
(4) 若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为____ ____L。
18.(8分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
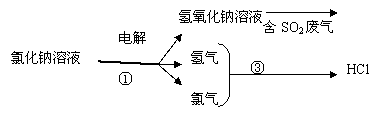
 (2)工业上利用电解饱和食盐水可制得化工产品,反应式为:食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
(2)工业上利用电解饱和食盐水可制得化工产品,反应式为:食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
|
|
|
|
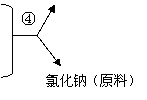
写出④的化学反应方程式:
(4)上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
17.(10分)中学化学中几种常见物质的转化关系如下:(提示:A有可变价态且与硫反应生成低价态)
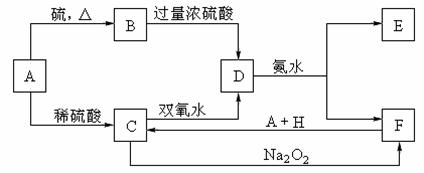
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围: 。
(2)B的化学式: 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
。
16、(12分)某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁片,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。(不考虑铁与水蒸气的反应及Fe2O3在高温下的分解反应,且铁钉中不含有其它杂质) ②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。请回答下列问题:
(1)铁锈中 (填“含有”或“不含有”)碳酸亚铁。理由是
(2)第②步所得的溶液中 含有Fe3+(填“是”或“否”)。请设计一个实验证明Fe3+是否存在
(3)锈蚀的铁钉中Fe2O3·H2O的质量为 。
15、 (8分)现有以下实验装置
(8分)现有以下实验装置

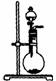
A B C D E
(1)适用于检验碳酸钠与碳酸氢钠两种固体的实验装置为 ;(填字母)
(2)已知实验室制Cl2还可用:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;则该反应
可在 装置中进行(填字母)。
(3)适用于CO还原氧化铁的实验装置为 (填字母);
(4)某同学选用E实验装置制取少量氨气,则所选用的试剂是 , ;
14.将一定量Fe和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.40mL B.45mL C.50mL D.无法确定
 请同学们将1-14答案填入下表:
请同学们将1-14答案填入下表:
第Ⅱ卷(非选择题 共72分)
13.某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 mol-0.6 mol之间
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0-0.6 mol之间
12.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: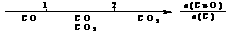
B.Fe在Cl2中的燃烧产物: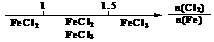
C.AlCl3溶液中滴加NaOH后铝的存在形式: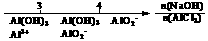
D.氨水与SO2反应后溶液中的铵盐: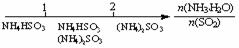
11.下列反应的离子方程式不正确的是
A.Ca(HCO3)2溶液与少量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
B.等物质的量浓度、等体积的NH4HCO3溶液与NaOH溶液相混合:
NH4+ + HCO3- + 2OH- = NH3·H2O + CO32- + H2O
C.铜片插入氯化铁溶液中 Cu+2Fe3+=Cu2++2Fe2+
D.氯气与水反应:Cl2+H2O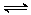 H++Cl-+HClO
H++Cl-+HClO
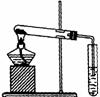
10.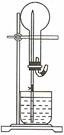 右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与试验事实不相符的是
右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与试验事实不相符的是
A.CO2(NaHCO3溶液) 无色喷泉 B.NH3(H2O含酚酞) 红色喷泉
C.H2S(CuSO4溶液) 黑色喷泉 D.HCl(AgNO3溶液) 白色喷泉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com