
题目列表(包括答案和解析)
16.[提出问题]与BaCl2溶液反应有沉淀生成
[实验探究]用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照 有淡黄色沉淀和无色刺激性气味气体产生
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
[问题讨论]⑴不正确,因氯水过量,氯水中同样含有Cl- ⑵取少量反应后的溶液,向其中滴入氯化钡溶液,若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化
(每空2分,共12分)
17.(1)C+2H2SO4 CO2↑+2SO2↑+2H2O (2)2:1
CO2↑+2SO2↑+2H2O (2)2:1
(3)2mol MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (4)漂白粉(漂粉精)
Mn2++Cl2↑+2H2O (4)漂白粉(漂粉精)
15.(1)红褐色; 4Fe(OH)2+O2+2H2O = 4Fe(OH)3↓。 (2)黄色固体; 向内; NaOH。
(3)NO; 3NO2+H2O = 2HNO3+NO。 (4)黄绿色变为无色; 5。
19.(强化班做)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
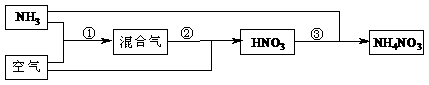
其中反应①为4NH3+5O2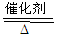 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________ ________________________。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
19.(普通班做)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
滴加溶液A的体积/mL |
5.0 |
10.0 |
15.0 |
|
生成气体的体积/mL(标准状况) |
44.8 |
89.6 |
112 |
⑴稀硫酸的物质的量浓度c= mol/L。
⑵计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=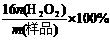 ]来衡量过碳酸钠产
]来衡量过碳酸钠产
品的优劣,13%以上者为优等品。
现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成
溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
18.(10分)下图表示各物质之间的转化关系,已知:A是一种由两种元素组成的化合物,它与足量的B的浓溶液反应能生成C、D、E三种物质,F是一种红褐色沉淀,常温下,L为无色液体,D、J为无色气体,I为气体单质,且J能使湿润的红色石蕊试纸变蓝。(部分反应物、生成物已略去)
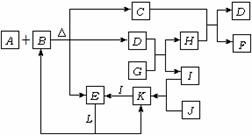
(1)D的电子式是 ,1mol D与足量G反应时转移电子的数目为 。
(2)写出C与H的水溶液反应的离子方程式: 。
(3)在一定条件下,E和J能否发生反应 (填“能”或“否”)若能发生反应,写出反应的化学方程式,若不能,说明理由 。
(4)若化合物A中某元素的质量分数为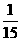 ,则A的化学式为
。
,则A的化学式为
。
17.(8分)如图所示:A、B、C、D为中学化学常见单质或化合物,下述反应均源于现行中学化学教材,按要求填空。
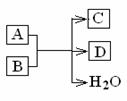
(1)若A为黑色单质,C为无色有刺激性气味的气体,则反应的方程式为
(2)若A为红色单质,该反应在常温下剧烈发生,则反应中氧化剂与还原剂物质的量之比为
(3)若A为黑色粉末,C为气态单质,产生1molC被氧化B的物质的量为
写出反应离子方程式____________________。
(4)若A为白色乳状物,溶解度随温度升高而降低,则该反应在工业上可用于制备_____
16.硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
[提出问题]Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
[实验探究]基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或 预期实验现象 |
现象解释 (用离子方程式表示) |
|
猜想② |
___________________________ __________________________ |
溶液pH=8 |
-------------------------- |
|
向pH = 2的硫酸中滴加Na2S2O3溶液 |
_______________ |
S2O32-+2H+ = S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
___________________________ ____________________________ |
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
[问题讨论]
⑴甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
___________________________________________________________________。
⑵请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 __________
_______________________________________________________________。
15.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
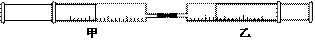
试回答下列问题:
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20 mL H2S |
10 mL SO2 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mol Cl2 |
40 mL NH3 |
|
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式________________________________________。
(2)实验2甲针筒内的现象是:有_______________生成,活塞__________移动(填“向外”、“向内”、“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入______________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色
气体是________,写出NO2与H2O反应的化学方程式________________________________。
(4)实验4中,已知:3Cl2+2NH3→N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生
外,气体的颜色变化为______________,最后针筒中剩余气体的体积约为______mL。
21.(12分)元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是 。(填相关元素的元素符号)
(2)请写出D的电子排布式:
(3)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式:
 (5)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
(5)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 。
20.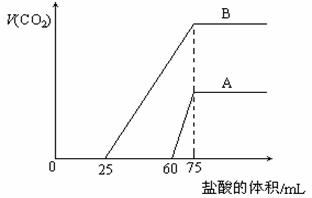 (12分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(12分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是什么?其物质的量之比为多少?
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com