
题目列表(包括答案和解析)
8.以下说法正确的是
A.非金属元素的原子间只形成共价键,金属元素的原子和非金属元素的原子间只形成离子键。
B.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
C.原子是化学变化中的最小微粒,即化学变化不产生新元素。核反应产生了新元素不为化学变化。
D.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在范德华力。
7.某化工厂的工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理,使之基本呈中性,处理方法如图所示:
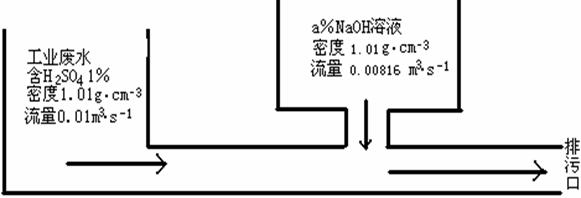
若处理后的废水pH=7,则所用NaOH溶液中溶质的质量分数为
A.0.5% B.1% C.2% D.4%
6.下列离子方程式表示正确的是
A.铜片加入稀硝酸中: Cu + NO3-+ 4 H+ Cu2+ + NO↑+ 2 H2O
Cu2+ + NO↑+ 2 H2O
B.过量SO2通入次氯酸钙溶液中:Ca2+ + 2ClO- + SO2 + H2O CaSO3↓+ 2HClO
CaSO3↓+ 2HClO
C.等体积、等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3-
+ Ba2+ + OH- BaCO3↓+ H2O
BaCO3↓+ H2O
D.铁作电极电解饱和食盐水:2Cl-+ 2H2O 2OH-+ H2 ↑+ Cl2↑
2OH-+ H2 ↑+ Cl2↑
5.关于氢键,下列说法正确的是
A.在水中,每个氧原子周围有4个氢原子,并分别与之形成氢键
B.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
C.氨易液化与氨分子间存在氢键无关
D.水是一种非常稳定的化合物,这是由于水分子间存在氢键所致
4.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂
C.氧化剂 D. 还原剂
3.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.将含有NO2和N2O4分子共约6.02×1023个的混合气,温度降至标准状况,其体积约为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数约为6.02×1022个
C.0.05molC5H12分子中所含共价键数约为6.02×1023
D.标准状况下,1molSiO2晶体中含有共价键数约为2×6.02×1023
2.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B. 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101KPa时 , 1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+01n→14C+11H,下列说法正确的是
A.14C和14N互为同位素
B.14C和C60是同素异形体
C.地球上活着的生物体内,由于新陈代谢作用也存在14C
D.14CO2的摩尔质量为46
19.⑴0.5(3分)
⑵n(O2)=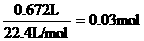
n(H2O2)=0.06mol
由实验Ⅰ中数据可知,5mLA溶液中:
n(Na2CO3)=n(CO2)= 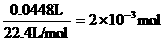
所以100mLA中含有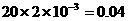 mol
mol
n(Na2CO3) ∶ n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3·3H2O2(3分)
⑶据题意可得:
n(H2O2)= n(Na2S2O3) /2=0.1mol/L×0.033L/2=1.65×10-3mol
该过碳酸钠的活性氧的质量分数为:
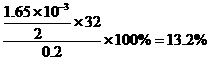 >13%(3分)
>13%(3分)
所以该过碳酸钠样品为优等品。(1分)
[解题提示]步骤②中发生的反应有两个:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,NO2可以看作中间产物,消去之可得总反应式。若每个反应均完全,由方程式可知NH3和O2的体积应相等,NH3与空气的体积比为1∶5。第⑶问由于对反应物的量没有限定,故应首先对此进行假设。
[答 案]⑴4NO+3O2+2H2O=4HNO3 ⑵1/6(或16.7%)
⑶解法一:假设消耗NH3的总物质的量为1mol,其中用于制取HNO3的NH3的物质的量为x mol,被HNO3吸收的NH3的物质的量为ymol,则有:x+y=1、abx=cy。
解得:x=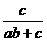 y=
y=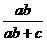
氨的总利用率=(xab+yc)/1=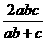
解法二:假设第①步参加反应的氨气的物质的量为4mol,则:
生成硝酸的物质的量4abmol;第③步需要氨气的物质的量为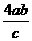 mol。
mol。
氨的总利用率=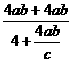 =
=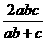
[难度系数]0.45(综合应用,较难)
18.(1)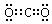 , NA
, NA
(2)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
 (3)能, 8NH3+6NO2
(3)能, 8NH3+6NO2
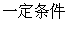 7N2+12H2O
7N2+12H2O
(4)Fe3C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com