
题目列表(包括答案和解析)
3.下列说法错误的是
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
2.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的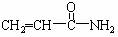 (丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:
(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:
①能使酸性KMnO4溶液褪色 ②能发生加聚反应生成高分子化合物
③只有4种同分异构体 ④能与氢气发生加成反应
其中正确的是
A.①②③ B.②③④ C.①③④ D.①②④
1.保护环境是每一个公民的责任。下列做法:
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理
③推广使用一次性木质筷子 ④推广使用清洁能源
⑤过量使用化肥、农药 ⑥推广使用无氟冰箱。
其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
28.(10 分)某芳香烃A有如下转化关系:
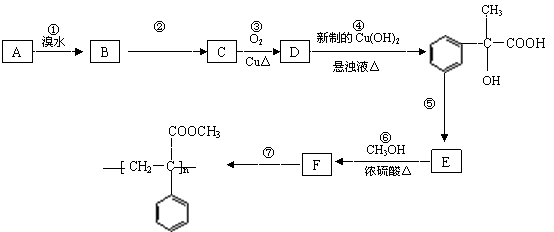
按要求填空:
⑴写出反应②和⑤的反应条件:② ;⑤ 。
⑵写出A和F结构简式:A ;F 。
⑶写出反应③对应的化学方程式:
③ 。
27.(9分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
⑴Y的最高价氧化物对应水化物的化学式是 。
⑵将ZY3溶液滴入沸水可得红褐色液体,反应的离子方程式是
,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
26.(6分)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为____________
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3十C  4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
25.(11分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
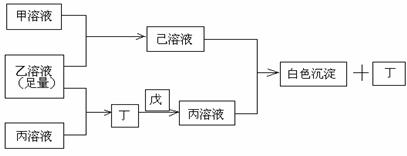
请回答:
(1)写出C元素的原子结构示意图_______________,写出丁和戊的电子式____________、_________________;
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________________________;
丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
24.(10分)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
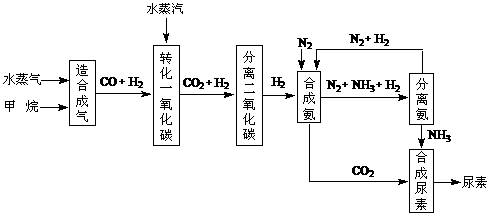
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: 。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请应用化学反应速率和化学平衡的观点说明采取该措施的理由: 。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
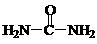
(4)已知尿素的结构简式为 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:① ,② 。
23.(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用________________ ____。
22.(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1) 溴在周期表中位于_________周期,_________族。
(2) 步骤①中用硫酸酸化可提高Cl2的利用率,为什么? 。
(3) 步骤④的离子方程式: 。
(4) 步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-900C。温度过高或过低都不利于生产,请解释原因: 。
(5) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“氯化、空气吹出、SO2吸收”: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com