
题目列表(包括答案和解析)
21、(10分)
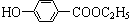 工业上用甲苯生产对-羟基苯甲酸乙酯: ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
工业上用甲苯生产对-羟基苯甲酸乙酯: ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
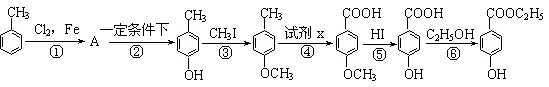
回答下列问题:
(1)有机物A的结构简式为___________________。
(2)反应②的化学方程式是:_______________________________________ ___。
(3)试剂x是 ,反应⑥的反应类型是 反应。
(4)反应⑤的化学方程式是:________________________________ _____。
(5)合成路线中设计③、⑤两步反应的目的是___________________________________。
20、(13分)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
a.课题名称:____________________________________________________________
b.实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、 、 、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
c. 实验步骤:略
d. 实验数据:
|
实验 编号 |
KClO3质量 (g) |
氧化物 |
产生气体(mL) |
耗时(S) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
e. 实验讨论:
(1)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(2)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
f.实验结论:_____________________________________________________________
19、(10分)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
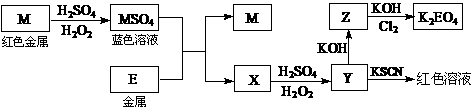
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关
的离子方程式: 、 。
⑶写出图中Cl2将Z氧化为K2EO4的化学方程式: 。
 ⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: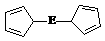 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
18、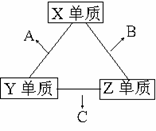 (12分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的反应,其中一个B分子中含有的Z原子个数比C分子中少1个。
(12分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的反应,其中一个B分子中含有的Z原子个数比C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是第 周期 族。
(2)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式): 。
(3)已知Y单质与Z单质生成C的反应是可逆反应, H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
A、达到化学平衡时,正反应速率和逆反应速率相等
B、达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
C、达到化学平衡的过程中气体平均相对分子质量减小
D、达到化学平衡后,升高温度,C的体积分数减小
17、(12分)下图中X是直流电源。两槽中c、d、e为石墨棒,f是铜棒,e、f两电极的质量相等。接通电路后,发现d附近显红色。
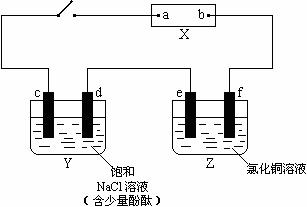
(1)①电源上a为 极;(用“正”、“负”、“阴”、“阳”填空)
②Z槽中f为 极(同上);
(2)①写出d极上反应的电极反应式 ;
②写出Y槽中总反应化学方程式 ;
③写出Z槽中e极上反应的电极反应式 ;
(3)电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,
①在通电过程中,电路中通过的电子为 mol;
②若Y槽中溶液体积为500mL(电解后可视为不变),槽中电解反应的速率
v(OH-)= 。
16、将一定质量的锌与10mL 18.5mol/L的浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体3.36L。将反应后的溶液稀释至100mL,测得溶液中c(H+)=0.1mol/L,则投入的锌的质量是 ( )
A.6.5g B.9.75g C.13g D.16.25g
第Ⅱ卷(共57分)
15、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/L NaHCO3溶液:c(CO32-)+c(OH-)=c(H+)+c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
14、25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb。下列有关a的说法正确的是( )
A、a可能等于1 B、a一定大于2
C、a一定小于2 D、a一定等于2
13、在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 ( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 ( )
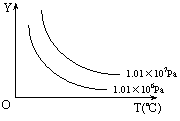
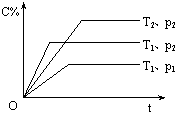
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
12、高温下,某反应达到平衡,平衡常数K=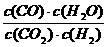 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
 D.该反应化学方程式为CO+H2O CO2+H2
D.该反应化学方程式为CO+H2O CO2+H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com