
题目列表(包括答案和解析)
23、 08四川延)(14分)有一白色固体混合物,可能含有的阴、阳离子分别是
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
|
阴离子 |
SO42- SO32- CO32- AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
|
排除的离子 |
排除的依据 |
|
|
|
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
|
肯定存在的离子 |
判断依据 |
|
|
|
|
排除的离子 |
排除的依据 |
|
|
|
(3)尚待检验的离子及其检验方法
|
尚待检验的离子 |
检验方法 |
|
|
|
(1)
|
排除的离子 |
排除的依据 |
|
NH4+ Ag+、Mg2+ |
由于溶液呈碱性,且未嗅到刺激性气味 碱性溶液中无沉淀生成 |
(2)
|
肯定存在的离子 |
判断依据 |
|
AlO2- CO32- |
加酸有沉淀,继续加酸沉淀溶解 加酸后有无色无味气体逸出 |
|
排除的离子 |
排除的依据 |
|
Ba2+
SO32- |
有CO32- 存在时原溶液无沉淀 酸化后逸出的气体没有刺激性气味 |
(3)
|
尚待检验的离子 |
检验方法 |
|
K+、 Na+ SO42- |
焰色反应 酸溶液中滴加BaCl2溶液,是否有白色沉淀生成 |
22、(08四川)(10分)D、E、X、Y是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、直线形。回答下列问题:
(1)上述4种元素中,能形成酸性最强的含氧酸的元素是___________,写出该元素的任意3种含氧酸的化学式:___________________________________;
(2)D和Y形成的化合物,其分子的空间构型为____________;
(3)D 和X形成的化合物,其化学式_______,化学键类型属___________,其晶体类型属__________;
(4)试比较D和X的最高价氧化物熔点的高低并说明理由:
_______
(1)非金属性越强,其对于拟稿含氧酸的酸性越强,在C、N、Si、Cl四种元素中Cl元素的非金属最强,对应的最高价氧化物酸性最强。对应的三种含氧酸为HClO、HClO3、HClO4。⑶D和Y形成的化合物为CCl4,空间构型为正四面体型。
⑷D和X形成的化合物为Si3C4,通过共价键形成原子晶体。
⑸D和X的最高价氧化物分别为CO2和SiO2因为CO2是分子晶体,SiO2是原子晶体,故SiO2熔点高于CO2。
[答案](1)Cl 、HClO HClO2 HClO3 HClO4(任写 3种酸)(3)正四面体型 (4)共价键 原子晶体(5)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间力结合,而后者为原子晶体,由共价键结合;共价键强度大于分子间力。
21、(082套)红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
答案:(1)2P(s)+3Cl2(g)=2PCl3(g) △H=-612kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol 25% 大于
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成。
(4)-399kJ/mol 等于
(5)PCl5+4H2O=H3PO4+5HCl
考点:化学反应与能量(热化学)
28.(14分)闪电是一种自然现象,地球上每年平均发生315160余次闪电。
(1)每当雷鸣电闪之时,空气可能会发生如下反应:
①N2+O2 2NO ②
③
④
2NO ②
③
④
(2)设某次闪电产生的能量为1.50×107kJ,已知每摩尔氧气和氮气化合时要吸收180.74kJ 的能量,闪电时有1/1000的能量用于这一反应,求:
①此次闪电所产生的NO的物质的量是多少?
②此次闪电的生成物相当于给土地施了多少kg尿素[CO(NH2)2]?
27.我国发射“神六”所用的“长征”2号火箭的主要燃料是偏二甲肼和四氧化二氮作为液体燃料。已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。
(1)通过计算写出偏二甲肼的化学式:________;
(2)在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该反应的化学方程式(反应中所有的氮元素均转化为N2)__________________________ 。
26.(10分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_____________。
(5) 和 两种粒子数量之和比OH-多0.008mol。
25.(10分)A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可制得A,若在A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断
(1)A是________,B是_________,C是_________,D是__________。
(2)完成有关方程式:
C A ________________________;A→C __________________________;
A ________________________;A→C __________________________;
B+C-→A _______________________________________________。
24.(7分)短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
|
A |
|
C |
|
|
B |
|
(1)A的氢化物分子式为 ;
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期 族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
23.(9分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
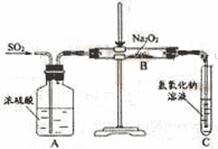
请回答下列问题:
(1) 第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
。
(2) 请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3) 第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明理由:
① ;② 。
22.(12分)1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用右图所示装置制备1,2- 二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
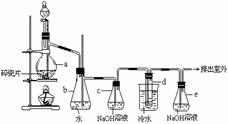 填写下列空白:
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式_________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: ____。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因:(写二种)__________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com