
题目列表(包括答案和解析)
18.(10分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与 、
、 的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(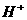 ),pCl=一lgc(
),pCl=一lgc( )]。
)]。
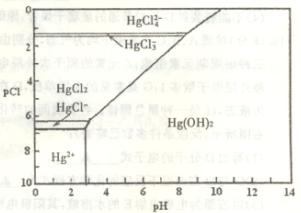 (1)正常海水(
(1)正常海水(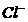 的浓度大于0.1mol/L) 中汞元素的主要存在形态是 ▲ 。
的浓度大于0.1mol/L) 中汞元素的主要存在形态是 ▲ 。
少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元
素的主要存在形态是 ▲ 。
(2)Hg(NC3)2固体易溶于水,但溶于水
时常常会出现浑浊,其原因是 ▲
(用离子方程式表示),为了防止出现
浑浊,可采取的措施是 ▲ 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含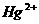 的废水。反应的离子方程式为 ▲ 。
的废水。反应的离子方程式为 ▲ 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6X10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= ▲ 。
17.(10分)下图是工业生产硝酸铵的流程。
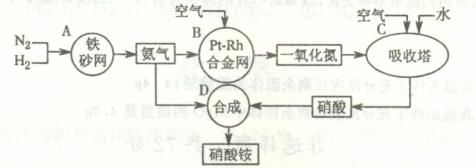
(1)吸收塔C中通入空气的目的是 ▲ 。A、B、C、D四个容器中的反应,属于氧化
还原反应的是 ▲ (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ▲ ,氨催化氧化反应的化学平衡常数表达式K= ▲ 。
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H=一92 kJ/mol。
2NH3(g) △H=一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 ▲ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达
到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为 ▲ 。
16. (8分)单质A、B、C在常温下均为气态,分别由X、Y、Z 三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z 三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(1)写出D分子的电子式 ▲ 。
(2)G与D在高温下反应的化学方程式为 ▲ 。
(3)以石墨为电极电解E的水溶液,其阳极电极反应式为 ▲ 。
(4)实验室检验F的水溶液中所含金属阳离子的操作方法、现象和结论是 ▲ 。
15.(10分)制取氟的氧氯化物ClO4F可采用特制的耐氟容器,使氟气缓缓地与10%的
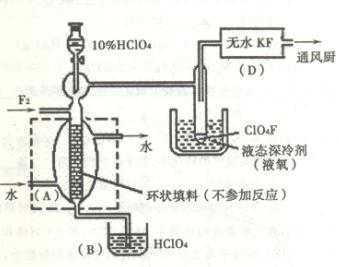 HClO4反应。其实验装置如图所示:
HClO4反应。其实验装置如图所示:
有关资料如下:
①无水KF易吸收F2、HF和H2O。
②ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸。
③F2的沸点为-188℃,HF的沸点为19.54℃,O2的沸点为-183℃。
试回答;
(1)写出制取ClO4F的化学方程式: ▲ 。
(2)装置A(虚线框内的仪器)的两个
作用是 ▲ 、 ▲ 。
(3)C中冷却剂选用液氧的理由是 ▲ 。
(4)不能将装置D换成普通的玻璃干燥管,原因是 ▲ 。
14.白云石化学式为CaCO3·x MgCO3。以它为原料,可制取耐火材料MgO等。称取27.6
g白云石样品,高温加热到质量不再变化,收集到CO2的体积为6.72 L(标准状况)。下
列说法正确的是
A.x=1
B.x=2
C.该样品高温条件下充分反应后剩余固体的质量是14.4g
D.该样品高温条件下充分反应后剩余固体中MgO的质量是4.0g
非选择题 共72分
13.下列溶液中离子浓度关系表示正确的是
A.NaHCO3溶液中: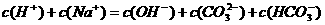
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中: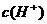 >
>
C.0.1mol/L的NH4Cl溶液中,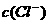 >
>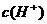 >
> >
>
D.物质的量浓度相等的CH3COOH 和CH3COONa溶液等体积混合后的溶液中:

12.在下列溶液中,各组离子一定能够大量共存的是
A.盐酸溶液中: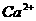 、
、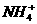 、
、 、
、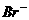
B.使pH试纸呈红色的溶液中: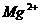 、
、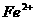 、
、 、
、
C.在氨水中: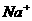 、
、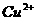 、
、 、
、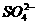
D.加入铝粉能产生氢气的溶液中: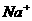 、
、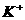 、
、 、
、
11.美丽的“水立方”(Water Cube)是北京奥运会游泳馆,采用膜材料ETFE(四氟乙烯和乙
烯的共聚物),为场馆带来更多的自然光。下列说法正确的是
A.ETFE的结构中,存在-CF2-CF2-CH2-CH2-连接方式
B.四氟乙烯与乙烯发生缩聚反应得到ETFE
C.以乙烯为原料经过加成反应、取代反应可制得乙二醇
D.ETFE材料是热固型(体型结构)的塑料
10.下列说法正确的是
A.2-丁烯不存在顺反异构体
B.离子化合物都是强电解质,共价化合物都是弱电解质
C.难得到电子的物质一定容易失去电子
D.乙醛的核磁共振氢谱中有二个峰,峰面积之比是l : 3
9.下述实验操作能达到预期实验目的的是
|
编号 |
实验操作 |
实验目的 |
|
A |
将10gCuSO4·5H2O溶解在90g水中 |
配制质量分数为10%的CuSO4溶液 |
|
B |
向盛有1 mL0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再滴加0.1 mol/L KI溶液 |
证明一种沉淀能转化为溶度积更小的另一种沉淀 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究温度对化学平衡的影响 |
|
D |
甲苯中滴入少量浓溴水,振荡,静置 |
证明甲苯能和溴发生取代反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com