
题目列表(包括答案和解析)
15.(8分)根据溴的性质,填写下列表格中关于液溴保存方法的选择及有关原因的解释:
①广口瓶②细口瓶③玻璃塞④橡皮塞⑤水封⑥煤油封⑦棕色瓶⑧无色瓶
|
|
选择保存方法 |
解释 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
l 16(10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
l 方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
l
l (1)加入过量的氯化钡溶液的目的是 。
l (2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,
l 说明 。
l (3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
l __________________________________________________________________________________________________________________________________________________________________________
l
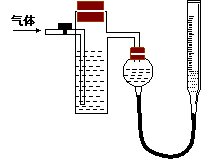 方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的 (填代号)代替:
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol·L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是 。
14.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为
1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
第Ⅱ卷(非选择题 共72分)
13.下列实验测量数据记录正确的是
A.用pH试纸测得0.100mol/mol醋酸的pH为3.02
B.用量筒测得排水法收集制得的氢气体为50.28mL
C.用滴定管测得中和滴定所消耗的标准溶液体积为20.32mL
D.用托盘天平称得2.50g胆矾受热充分失水后,固体质量减轻0.90g
12.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3-+2OH-====CaCO3↓+ 2H2O + CO32-
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
11.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
10. 设NA表示阿伏加德罗常数,下列叙述中正确的是 :
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.常温常压下1 mol NO2气体与水反应生成NA个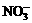 离子
离子
9.在下列实验中,可能达不到目的的是
A.用金属钠与水或乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 B.用铂(Pt)电极电解Cu(NO3)2 、AgNO3 混合溶液,比较铜和银的金属活泼性 C.检测等物质的量浓度H3PO4和 H2SO4的酸性强弱,比较磷和硫两元素非金属性的强弱.
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
21.选做题(共计12分)本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”
两个选修课程模块的内容,每题12分。请选择其中一题作答,并把所选题且对应字母
后的方框涂黑。若两题都作答,将按A题评分。
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ▲ ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是
▲ 。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ▲ ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 ▲ 。

(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合
物的化学式为 ▲ ;
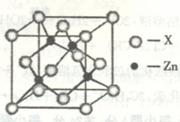
该化合物的晶体熔点比干冰高得多,原因是 ▲ 。
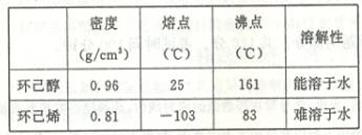
B.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为原料制备环己烯
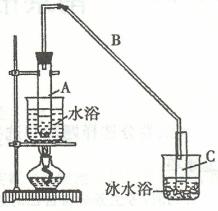 已知:
已知: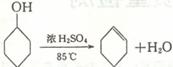
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。导管B除了导气外还具有的作用是 ▲ 。
(2)制备精品
 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
▲ (填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
②蒸馏时要加入生石灰,目的是 ▲ 。
③实验制得的环己烯精品质量低于理论产量,可能的原因是 ▲
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 ▲ 。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
(4)用溴的四氯化碳溶液可以检验环已烯,写出它们反应的化学方程式 ▲ 。

天星教育网() 版权所有
天星教育网() 版权所有
天星教育网() 版权所有
20.(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上制备无水AlCl3的
方法是:将一定粒度的铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)
按一定配比投入焙烧炉中加热至800℃,再将焙烧过的物料投入到氯化炉中,然后通入
Cl2和O2,于950℃在石油焦还原剂的存在下,Al2O3跟Cl2反应,生成气态的AlCl3
经冷却后得到氯化铝粗产品(杂质的成分是FeCl3)。尾气中含有大量CO和少量Cl2,用
碱液或Na2SO4溶液除去Cl2,并回收CO。精制AlCI3粗产品一般用升华法。在升华器
内,加入NaCl固体,同时加入少量某种物质X,将FeCl3杂质还原成Fe作为废渣除
去,再经升华就得到精制的AlCl3。回答下列问题:
(1)氯化炉中通入O2的目的是 ▲ 。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是 ▲ 。
(3)用Na2SO3溶液处理尾气时发生反应的离子方程式是 ▲ 。
(4)精制AlCl3粗产品时,需加入少量物质X。X可能是下列物质中的 ▲ 。(填
字母)
A.FeCl2固体 B.Fe粉 C.Al粉
(5)精制无水AlCl3合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精
制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、
灼烧、冷却、称重,其残留固体质量为0.16g。试计算该样品中AlCl3的质量分数(写
出计算过程)。
19.(12分)芬必得是一种解热镇痛药物,其有效成分是布洛芬(Ibuprofen)。下列是某公司新发明的布洛芬(Ibuprofen)绿色合成方法流程图(反应条件省略)。
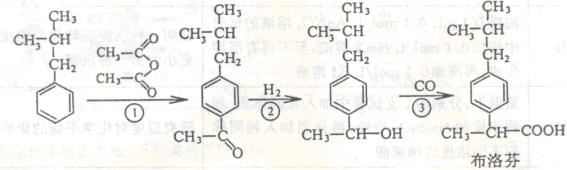
试回答下列问题:
(1)布洛芬分子中有 ▲ 个手性碳原子。
(2)反应①属于取代反应,试写出反应①的化学方程式: ▲ 。
(3)反应②的反应类型是 ▲ 反应。
(4)与布洛芬互为同分异构体的芳香族化合物中有一类属于酯,其结构可表示为:
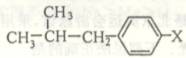
则X的结构有 ▲ 种(填数字)。
(5)已知Reppe反应: 。某学生提议用RePPe反应一步合成布洛芬,并使原子利用率为100%,写出用一种有机
。某学生提议用RePPe反应一步合成布洛芬,并使原子利用率为100%,写出用一种有机
物(其它无机试剂任选)一步合成布洛芬的化学方程式 ▲ 。
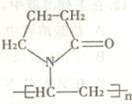 (6)聚乙烯吡咯烷酮是芬必得中的辅料,其结构简式如右图。
(6)聚乙烯吡咯烷酮是芬必得中的辅料,其结构简式如右图。
试写出聚乙烯砒咯烷酮在一定条件下水解产物的结构简式
▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com