
题目列表(包括答案和解析)
4、25℃时,某物质(无结晶水)溶解度为S g,其摩尔质量为M g/mol,饱和溶液密度为d g/cm3。则其饱和溶液的物质的量浓度为
A.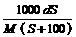 mol/L
B.
mol/L
B.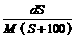 mol/L
mol/L
C.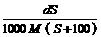 mol/L
D.
mol/L
D.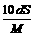 mol/L
mol/L
3、下列各种情况下,溶液中一定能大量存在的离子组是
A.能使 pH 试纸变深蓝色的溶液中: S2一、SO32-、CO32-、Na +
B.含有大量 NO3-的溶液: H+、 Fe2+、 SO42-、Cl-
C.由水电离出的 c ( H十)= l×l0-12 mol / L 的溶液中: K+、Na+、Cl一、SO32-
D.含有大量 A1O2-的溶液: Na+、NH4+、SO42-、HCO3-
2、大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定是没有意义的是
A.探究S02和Na202反应可能有Na2S04生成
B.探究Na与水的反应可能有02生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的Na0H溶液中通以 Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
1、化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50mL量筒取5.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液。
A.①②④ B.②③④⑥ C.③⑥ D.③⑤⑥
22.在500mLCuSO4和Fe2(SO4)3的混和溶液中加入21.7g 铁粉,待反应完全后,得到16.8g残留固体。在滤液中加入400mL4mol / L的BaCl2溶液,恰好使溶液中的SO42-完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
新海高级中学2008-2009学年高三化学九月质量检查试题
21.(10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
程式:
 A12Te3 + ( ) A1(OH)3↓ + H2Te↑
A12Te3 + ( ) A1(OH)3↓ + H2Te↑
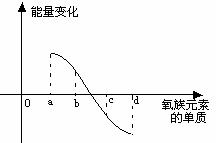
(6)右图所示为氧族元素单质与H2反应过程中的能
量变化示意图,其中a、b、c、d分别表示氧族中某
一元素的单质,△E为相同物质的量的单质与H2反应
过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
20.(8分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
19.(8分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-1离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
(4)C、D元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为
..
(5)用电子式表示A、C两元素形成的化合物:
18.(9分)已知主族元素X、Y、Z、W是分布于元素周期表中三个短周期里的非金属元素,其原子序数依次增大。W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的1/3。Y的氢化物分子中有三个共价键。
(1)Y的氢化物分子属于 分子(填“极性”或“非极性”),Y的氢化物的沸点比相邻同主族元素氢化物的沸点高,其原因是 。
Y的氢化物与质子反应的产物的电子式为 ,
此产物的空间形状呈 。
(2)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式)
, .
(3)我国材料学家已 功制备了W元素与Y元素组成的耐高温的新型材料W3Y4。工业上可用W的氢化物与Y的氢化物反应制得该耐高温化合物和氢气,此反应的化学方程式为:
, , .
17.(10分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
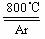 TiO2
+2C+2Cl2
TiO2
+2C+2Cl2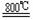 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
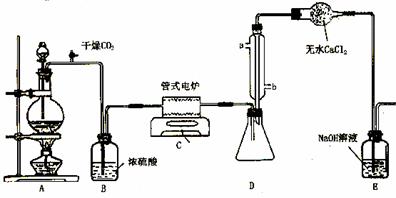
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
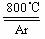 TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com