
题目列表(包括答案和解析)
23.(10分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。
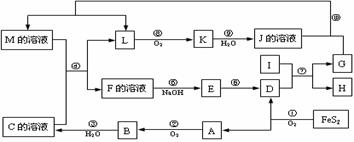
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_______(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________
24(9分).已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
样品质量(g) |
9.6 |
12.8 |
64.0 |
|
气体体积(L) |
5.04 |
6.72 |
V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
⑴a组实验结束后,溶液中c(NO3-)= ;
⑵b组实验结束后,溶液的pH= ;
⑶计算实验c中所产生气体的体积(V)。
;


22.(15分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I]
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II]
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的全部溶液,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III]
(1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
;
问题2:本方案中的“冷却”应如何操作
。
[方案IV]
(1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案分别缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
21.(6分)下列实验操作或实验叙述正确的是 (填序号)
①配制氯化亚铁溶液时,需加少量盐酸及铁粉;
②用10 mL量筒量取5.80 mL盐酸;
③用稀醋酸可除去热水瓶内的水垢;
④检验卤代烃中卤素时,可将卤代烃直接加入硝酸酸化的硝酸银溶液中
⑤金属钠着火可用干燥的细沙扑灭;
⑥用排水法收集氢气时,不需要检验纯度,可直接点燃;
⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液,再滴入酚酞试液;
⑧可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸。
20.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
Ⅱ卷
19.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
18.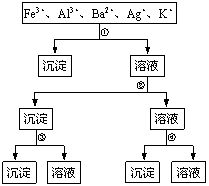 用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右
用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右
图所示步骤分开五种离子。则溶液①、②、③、④是
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①NaCl ②NH3·H2O ③NaOH ④H2SO4
C.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
D.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
16.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应符合离子方程式2H++SO32-=H2O+SO2的化学方程式个数有
A.4 B.6 C.8 D.12
17燃烧1g液态有机物,只生成0.05molCO2气体和1.2g液态水,且放出热量33.63kJ,该有机物的蒸汽对H2的相对密度为30,则该有机物燃烧的热化学方程式为( )
A.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(l); △H=-2017.8kJ/mol
B.C3H8 (l)+5O2(g)=3CO2(g)+4H2O(l); △H=-33.63kJ/mol
C.C3H8(l)+5O2(g)=3CO2(g)+4H2O(l); △H=-1479.4kJ/mol
D.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(g); △H=-2017.8kJmol
15.下列两种溶液反应,将第一种溶液滴入第二种溶液与将第二种溶液滴入第一种溶液时发生的反应不完全相同的是
①AlCl3与NaOH ②AgNO3与氨水 ③Na3PO4与H2SO4
④NaAlO2与盐酸 ⑤苯酚钠与盐酸
A.①②⑤ B.①②③④ C.②③⑤ D.全部
14.向100mL的FeBr2溶液中,通入标准状况下Cl22.24L,溶液中的Fe2+恰好全部被氧化(已知:2Fe2++Br2=2Fe3++2Br-),则原FeBr2溶液的物质的量浓度是(不考虑溶液体积的变化)( )
A.0.75 mol•L-1 B.1.5 mol•L-1 C.2 mol•L-1 D.3 mol•L-1
13. FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
A.120N/a B.120a/11N C.11a/120N D.120N/11a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com