
题目列表(包括答案和解析)
4.设阿伏加德罗常数为NA。下列叙述中正确的是 ( )
A.0.1mol铁与0.1molC12充分反应,转移的电子数为0.3NA
B.60 g 二氧化硅晶体中含有二氧化硅分子数为6.02×1023
C.标准状况下,11.2 L D2分子中含有的中子数为6.02×1023
D.标准状况下,l L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)NA
3、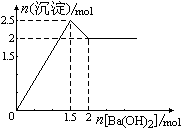 右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A.MgSO4 B.Al2(SO4)3
C.KAl(SO4)2 D.NaAlO2
2、 下列实验操作安全正确的是
下列实验操作安全正确的是
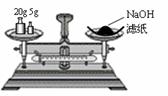
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
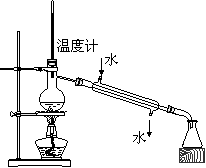
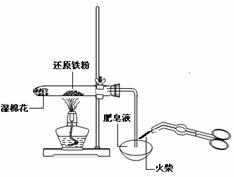
C.检验铁粉与水蒸气反应产生的氢气 D.分离两种互溶但沸点相差较大的液体混合物
1、“纳米材料”(1nm=10-9m)是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,对于所得分散系的叙述正确的是
①一定是溶液 ②能全部透过半透膜 ③有丁达尔现象 ④可以全部透过滤纸
A.①② B.②③ C.①④ D.③④
25.(8分)将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g·cm-3氨水。
(1)所得氨水的物质的量浓度
(2)取上述氨水30.0mL与70.0ml 2.00mol·L-1的AlCl3溶液相混合,产生的白色沉淀
的质量是
(3)往上述反应后未过滤的溶液中加入一定体积的5mol·L-1的NaOH溶液后,混合后体系中
沉淀的质量与上述(2)中产生的沉淀质量相等,加入的NaOH溶液的体积是 ml
班级 学号 姓名
25.(8分)某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应。在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯口相平。然后在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板做盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中放出的热量可计算中和热。试回答下列问题:
(1)本实验用稍过量的NaOH的原因教材中说是为了保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得中和热数值 (填“偏高”,“偏低”或“不变”);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度(t1)/℃ |
终止温度 (t2)℃ |
温差 (t2- t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3 中和后混合液的比热容
C=4.18J/(g.℃) Q=C.m.△t 则该反应的中和热为△H= ;
(3)若用等浓度的醋酸与溶液反应,则测得的中和热的数值会 (偏高,偏低或不变),其原因是 。
24.(8分)用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1 H2SO4,其操作可分为以下几步:
A、用量筒量取5.4mL浓H2SO4,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
 B、用约30mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次洗液都倒入容量瓶里
B、用约30mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次洗液都倒入容量瓶里
C、将稀释后的H2SO4小心地倒入容量瓶里
D、检查100mL容量瓶口部是否发生滴漏
E、将蒸馏水直接加入容量瓶,至液面接近刻度线0.5-1cm处
F、盖紧瓶塞,反复颠倒振荡,摇匀溶液
G、用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和刻度线相切,据此填写:
(1)正确的操作顺序是(用字母填写): ;
(2)进行A步操作应选择下列量器:①10mL量筒②50mL量筒③500mL量筒④1000mL量筒中的(填序号) 。如果对装有浓H2SO4的量筒读数如右上图所示,配制的稀H2SO4的浓度将(偏高、偏低、无影响) 。
(3)进行A步操作后,必须 后才能进行下一步操作。
23.(18分)下表中的实线表示元素周期表的部分边界。①--⑧分别表示元素周期表中对应位置的元素。
(1)请在表中用实线补全元素周期表的边界。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
② |
③ |
|
|
④ |
|
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)元素③④⑤⑥的原子半径由大到小的顺序是: 。元素⑤、⑥的最高价氧化物对应水化物的酸性强弱为: ﹥ 。(用化学式表示)
(3)元素③⑦⑧的氢化物的沸点由高到低的顺序为 。(用化学式表示)。
(4)元素①的氢化物的电子式为 。该分子属于(填“极性”或“非极性”) 分子。
(5)元素⑤在生产生活中有重要用途。写出工业制取其单质的化学方程式: 。元素⑤与⑦形成的化合物有净水作用,写出其与水作用的离子方程式: 。
(6)元素④与⑦形成的化合物是一种重要的工业原料,写出工业电解其水溶液时的离子方程式: 。
(7)已知一定条件下,1mol⑥的固体单质在②的单质中充分反应放热297KJ。写出此条件下该反应的热化学方程式 。
22.(12分)有A、B、C、D四种无色可溶性盐分别是由Na+、Mg2+ 、Ag+、 、Ba2+ 、、Cl- ,CO32-、 HCO3- 、 NO3-中不同的阴阳离子所组成。A溶液与硫酸反应只有气体生成,B溶液与硫酸反应只有沉淀生成,C溶液与硫酸反应既有气体生成又有沉淀生成,D溶液与硫酸反应既无气体生成又无沉淀生成,则:
(1)A为 、B为 、D为 。
(2)分别写出C与H2SO4和NaOH反应的三个离子方程式:
①C与足量硫酸溶液 。
②C与足量NaOH溶液 。
③C与少量NaOH溶液 。
21.(6分)在热的稀硫酸溶液中溶解了11.4克FeSO4。当加入50mL0.5mol/LKNO3溶液后,其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
(1)反应中的氧化剂是 。
(2)推算出x ,y 。
(3)配平该化学方程式: FeSO4+ KNO3+ H2SO4 → K2SO4+ Fe2(SO4)3+ NxOy+ H2O ;反应中电子转移个数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com