
题目列表(包括答案和解析)
3.乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( )
A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
2.将1L1.00mol/L的Na2CO3溶液逐滴加入到1L1.25mol/L的盐酸溶液中,再做相反操作:即将1L1.25mol/L的盐酸逐滴加入1L1.00mol/L的Na2CO3溶液中,两次操作在同温同压下产生的气体体积比是 ( )
A.2∶5 B.1∶1 C.2∶1 D.5∶2
1.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.Na2O2与CO2反应生成1 molO2时转移的电子数为4 NA
B.1molSiO2中所含共价键数为2NA
C.标准状况下,11.2L SO3中含1.5NA个氧原子
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
可能用到的相对原子质量:H1 N14 O16 Cl 36.5 Fe 56 S 32
21.(11分)江苏东海有蛭石。蛭石为一种层状结构的含镁的水铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/3的Si被Al置换,再由K平衡其电荷形成的。
该矿石得组成以氧化物的形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
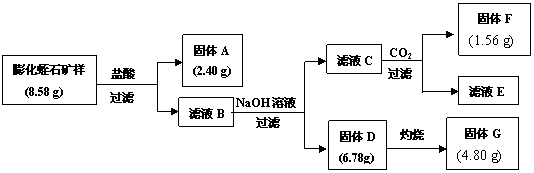
①固体A的化学式是
②固体F的物质的量是
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式
20、(1)(6分)氮化硅Si3N4是一种非氧化物高温陶瓷结构材料。粉末状的Si3N4可以由SiCl4的蒸气和NH3气的混合物反应制取。粉末状Si3N4对空气和水都不稳定,粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸;粉末状Si3N4与空气接触能产生N2和另外一种物质。但是,将粉末状Si3N4和适量MgO(难熔)在230℃1.01×105Pa和185℃的密闭容器中热处理,可以得到结构十分紧密、对空气和水都相当稳定的固体材料。
①写出由SiCl4和NH3制备Si3N4的反应方程式: 。
②分别写出粉末状Si3N4和H2O及O2反应的方程式:
______________________________________________________ ;
______________________________________________________ 。
(2)(4分)图瓦卢是由珊瑚礁形成的岛国,由于大气中CO2含量的剧增,大量的珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示) ;而大气中CO2剧增的人为原因主要是 。
19.(11分)中学化学中几种常见物质的转化关系如下:(提示:A与硫反应生成低价态)
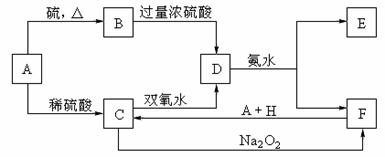
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)在溶液中C与Na2O2等物质的量反应生成F,写出该反应的化学方程式:
18.(10分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试
一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反
应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5= 4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ;为什么填这一物质,试用氧化还原反应理论解释: ;并配平反应① 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ;被氧化的元素为 。
17.(8分)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
__C+__K2Cr2O7 +__H2SO4 →__CO2+__K2SO4+__Cr2(SO4)3 +__ H2O
(1)配平上述反应的化学方程式
(2)上述反应中氧化剂是________(填化学式) 被氧化的元素是________(填元素符号)
(3)H2SO4 在上述反应中表现出来的性质是____________(填选项编号)
(A) 氧化性 (B) 氧化性和酸性 (C)酸性 (D)还原性和酸性
(4) 若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为________L
16.(8分)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在形同的室温下对该产品的两个探究实验:
[实验1]向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mil氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mil氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mil氯化钠粉末;
 [实验2]向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
[实验2]向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
⑴实验1证实影响镁与水反应速率的主要因素是_________________。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
⑵实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________。
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
⑶如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于______。
A.34℃ B.42℃ C.50℃ D.62℃
⑷铁粉、NaCl能使反应速率增加的原因是______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com