
题目列表(包括答案和解析)
5.在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A.36% B.54.5% C.40% D.33.3%
4.实验指出,无水氯化铝在标准大气压条件下不同温度时的密度为:
|
T(℃) |
200 |
600 |
800 |
|
d(g/mL) |
6.8×10-3 |
2.65×10-3 |
1.51×10-3 |
可见,600℃时无水氯化铝存在形式的化学式为
A.AlCl3 B.Al2Cl6 C.AlCl3、Al2Cl6 D.Al3Cl9
3.将物质的量均为a mol的钠和铝一同投入mg水中(水足量),所得溶液的密度为
ρg·cm-3,则此溶液的物质的量浓度为
A.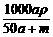 mol·L-1 B.
mol·L-1 B.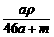 mol·L-1
mol·L-1
C.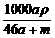 mol·L-1 D.
mol·L-1 D. 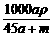 mol·L-1
mol·L-1
2.将a g Fe2O3、Al2O3样品溶解在过量的200 mL pH=1的硫酸溶液中,然后向其中加
入NaOH溶液使Fe3+、Al3+ 刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.4 mol·L-1 D.0.8 mol·L-1
1.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁,以下优点分析错误的是
A.副产工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
21. 工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气____________m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水_____________吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为______________%。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且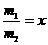 ,需补充水y吨,则y与x的关系式为________________;若不补充水,则m1+m2=__________。
,需补充水y吨,则y与x的关系式为________________;若不补充水,则m1+m2=__________。
20、(10分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。回答下列问题:
⑴ 合成氨工业中原料气压缩到30-50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
⑵ 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
⑶ 甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
⑷ 有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
19.(10分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4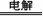 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
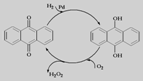
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
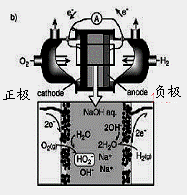
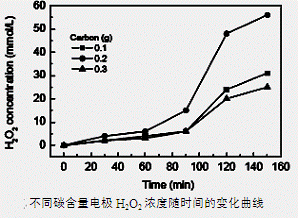
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚:
①水样加入氢氧化铝悬浊液振荡过滤
②若水样中有可溶性硫化物,需加氢氧化钠调至中性或弱碱性后,加入30%过氧化氢
③若水样含高铁离子或铬酸盐,可加2mL新配制的对苯二酚溶液
④加入5-10滴混合指示剂,用0.025mol/LHg(NO3)2标准溶液滴淀水样,滴定至蓝紫色。
试回答下列问题
(1)水样中加入氢氧化铝悬浊液的作用是: 。
(2)加入过氧化氢发生的离子反应为: 。
(3)加入对苯二酚的作用是: 。
(4)若滴定到终点时俯视滴定管读数,会导致水样中氯化物含量测定结果 (填“偏高”、“无影响”或“偏低”)。
(5)若用V1--水样消耗硝酸汞标准溶液的体积(mL),c--硝酸汞溶液浓度(mol/L),V--水样的体积(mL),则水样中氯离子的含量计算公式为:
氯化物(Cl-,mg/L)= (用字母表示)。
18.(8分)马格尼特法冶炼镁的工艺流程如下图。炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣。
已知白云石的成分为CaCO3·MgCO3,硅铁是指含有55%硅左右的铁[可表示为Si(Fe)],作还原剂,最后得到低品位的硅铁[可表示为Fe(Si)]简易流程图如下:
试回答下列问题
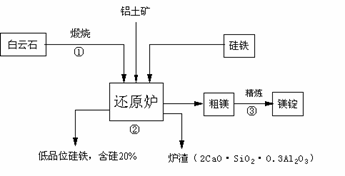 (1)反应①,白云石煅烧得CaO·MgO的化学方程式为:
。
(1)反应①,白云石煅烧得CaO·MgO的化学方程式为:
。
(2)反应②,还原炉中发生反应生成镁和炉渣的化学方程式为: 。
(3)该成分的沪渣是一种工业生产的重要原料,可作为生产 原料。
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁 吨
①配制氯化钠标准溶液和硝酸汞溶液,并用氯化钠标准溶液标定硝酸汞溶液
②配制氢氧化铝悬浊液、30%过氧化氢溶液及1%对苯二酚溶液等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com