
题目列表(包括答案和解析)
18.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I―+2H+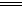 I2+Z+H2O常作为Y的鉴定反应。
I2+Z+H2O常作为Y的鉴定反应。
⑴Y与Z的关系是(选填字母) 。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
⑵将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法 。
⑶举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
。
⑷气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是 。
②KCN溶液显碱性,原因是(用离子方程式表示) 。
⑸加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m:n=
(用含w1、w2和a的代数式表示)。
17.资料显示不同浓度的硫酸与锌反应时,
硫酸可以被还原为SO2,也可被还原为氢气。为
了验证这一事实,某同学拟用下图装置进行实验
(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4
反应,为保证实验结论的可靠,在洗气瓶中
加入1mol/L NaOH溶液的体积V≥_______mL,
量气管的适宜规格是_____________mL。
(选填:200,400,500)。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则发生反应的化学方程式
为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是;____________________________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
依据反应I2 + 2S2O32- = 2I- + S4O62-,该小组的实验步骤如下:
① 称取5g食盐,加适量蒸馏水使其完全溶解;
② 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
③ 以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液5.0mL,恰好反应完全。
(3)判断步骤③中恰好完全反应的实验现象是: 。
(4)根据以上实验数据,“自然晶盐”的碘含量为 mg/kg(精确到0.01),该食用碘盐 (填“合格”或“不合格”)。
16.化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2.1。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol·L-1的H2S溶液的pH约为4.5。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重、冷却、质量为12.60g。
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250mL溶液,测得pH=10.3。
[分析猜想] Na2SO3·7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行 次
(2)给Na2SO3·7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
。
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证。请简单叙述实验步骤、现象和结论。
他们首先上网查阅了资料,搜索到“含碘盐中含有的碘酸钾(KIO3)在酸性条件下可以将KI中的碘离子氧化成碘单质,碘单质既是氧化产物又是还原产物”。
(1)在试管中加入少量“自然晶盐”溶液和KI溶液,然后滴入几滴稀H2SO4 ,最后再滴入 ,振荡试管,观察到 时,则说明该“自然晶盐”中含有碘元素,反应的化学方程式是 。
(2)实验后,他们在继续查阅资料时发现“空气中的氧气也能氧化I-,反应为4 I- + O2 + 4H+ = 2I2 + 2H2O”,所以认为上述结论不严谨。于是小组经过讨论后决定,增加一个对照实验以排除氧气对上述实验的干扰。简述该对照实验的操作步骤:
21.粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2 ,有关化学方程式为:
Al6Si2O13 + 3Na2CO3 → 2NaAlSiO4 + 4NaAlO2 +3CO2↑
Al6Si2O13 + 5Na2CO3 → 2Na2SiO3 +6NaAlO2 +5CO2↑
SiO2 + Na2CO3 → Na2SiO3 +CO2↑
(1)粉煤灰中铝元素的质量分数为 %。
(2)用1mol Al6Si2O13和4mol SiO2 制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3
mol,共消耗Na2CO3 mol(得到的固体中无SiO2)。
(3)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4)∶n(NaAlO2)=x,消耗Na2CO3 y mol,试确定x与y的关系式。
20.(11分)三氯化铁是中学化学实验室 中必不可少的重要试剂。某兴趣小组
利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3•6H2O,该同
学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀
硝酸,实验时打开a ,关闭b ,从分液漏斗内向A中加过量的稀盐酸,此
时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3•6H2O晶体。
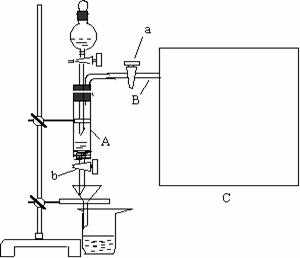
填写下列空白:
⑴ 如何检查装置A的气密性:
⑵ 滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是
⑶ 将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由
⑷ 用该法制得的晶体中往往混有Fe (NO3) 3,为了制得较纯净的FeCl3•6H2O,可将烧杯内的稀硝酸换成 。
⑸ 若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为: (用含m、V的代数式表示),请在框图C中画出必要的装置。
19.日常生活中使用铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
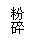




一些氢氧化物沉淀的pH如下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
|
开始沉淀pH(离子初始浓度0.01mol/L) |
4 |
2.3 |
10.4 |
|
完全沉淀pH(离子浓度<10-5mol/L) |
5.2 |
4.1 |
12.4 |
(1)加入盐酸时,氧化铝发生反应的离子方程式为 。
(2)实验室进行步骤②③④的操作名称为 。
(3)固体A的化学式为 ,物质C的化学式为 ;溶液中的Na+、Ca2+、Mg2+是在步骤 中除去的。
(4)步骤③调节pH的数值范为 ,步骤④调节pH的数值范为 。
(5)步骤⑥反应的化学方程式为: 。
18. (10分)金属钛被誉为“廿一世纪金属”,有“生物金属,海洋金属,太空金属”美称;具有低密度,高强度,耐腐蚀性,耐高温,记忆能力等优良性能。金属钛的制备方法如下:
(1)金属钛在加热时可与浓NaOH作用,写出浓热的碱作用的的化学方程式 ;
(2)D有多种晶体结构,其中的金红石是四方结构;E是分子晶体,常温呈液体,而极易水解,E还用作军事烟雾剂,写出D、E的化学式 ;请你用方程式解析E为什么可用作军事烟雾剂 。
(3)写出②、③反应方程式(如是离子反应写离子方程式)
;
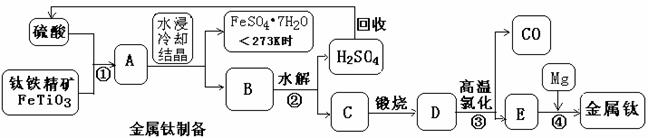
17.铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
(1)用化学式表示滤液甲的主要成分是 。
(2)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2― b.OH― C.SiO32―
(3)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。写出阴极的电极反应方程式 ,沉淀消失的原因可用离子方程式表示为: 。
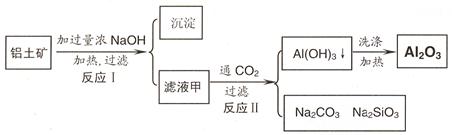
(4)取 (3) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
16.(12分)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下(下图):

⑴ 精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],反应的化学方程式为 。
⑵ 合成反应后,继续在393K~523K下水热处理8h,发反应:
Mg(OH)2-xClx·mH2O=(1-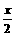 )Mg(OH)2+
)Mg(OH)2+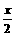 MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
⑶ 已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g) △H1=+81.5kJ·mol-1
Al(OH)3(s)=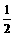 Al2O3(s)+
Al2O3(s)+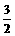 H2O(g) △H2=+87.7kJ·mol-1
H2O(g) △H2=+87.7kJ·mol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 ,等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 。
⑷ 常用阻燃剂主要有三类:
A.卤系,如四溴乙烷
B.磷系,如磷酸三苯酯
C.无机类,主要是Mg(OH)2和Al(OH)3
从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com