
题目列表(包括答案和解析)
27、(10分)分子筛是一类具有多孔性的铝硅酸钠盐。分子筛晶体中的骨架是由SiO4四面体和AlO4四面体通过顶角的氧原子连接而成的,经测定硅铝比(SiO2-Al2O3的物质的量之比)为6:3,AlO4四面体带一个单位负电荷。SiO4可表示为:
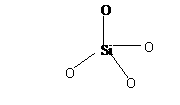
(1)写出Al原子的电子排布式
(2)该分子筛的化学式为
(3)在SiO4四面体,硅、氧原子个数比为 (1分),硅、氧之间的成键方式为
(4)O、Si、Al三种元素的单质晶体中,熔、沸点最高的是
(5)该分子筛能把空气中的O2和N2分离提纯得到O2,原理是
2008年高三化学模拟考试试题
26、(10分)
A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR'
在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基)。

回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为_____________;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是___________,反应类型为_____:
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________________
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,其相应的结构简式是__________________。
25、(9分)近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
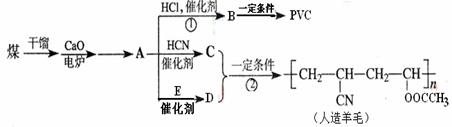
请回答下列问题:
⑴写出反应类型 反应① 反应② 。
⑵写出结构简式 PVC ; C 。
⑶写出A D的化学反应方程式
。
D的化学反应方程式
。
⑷与D互为同分异构体且可发生碱性水解的物质有 种(不包括环状化合物),写出其中一种的结构简式 。
24、(11分)现有下列短周期元素性质的相关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上表中各元素最高价氧化物对应的水化物中,酸性最强的是(填酸的化学式)
,该元素在元素周期表中的位置是___________________。
(2)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则。上表中与铍的化学性质相似的元素有(填元素名称) 。铍的最高价氧化物对应水化物属两性化合物,该化合物的化学式是 ,能够说明其具有两性的反应的离子方程式为 ;
。
(3)元素⑥的金属性比元素②要 (填“强”或“弱”),试从物质结构方面解释其原因:
。
(4)实验室现有元素②的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种实验方案 。
23、(10分)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
N2O4  2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s)n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A. 增大N2O4的起始浓度
B. 向混合气体中通入NO2
C. 使用高效催化剂
D. 升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

22、(13分)“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________________________。(填序号)
A.2H2(g)+O2(g)
 2H2O(l);△H=-142.9kJ·mol-1
2H2O(l);△H=-142.9kJ·mol-1
B.H2(g)+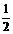 O2(g)
O2(g)  H2O(l);△H=-285.8kJ·mol-1
H2O(l);△H=-285.8kJ·mol-1
C.2H2+O2 2H2O(l);△H=-571.6kJ·mol-1
2H2O(l);△H=-571.6kJ·mol-1
D.H2(g)+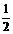 O2(g)
O2(g)  H2O(g);△H=-285.8kJ·mol-1
H2O(g);△H=-285.8kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg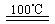 HgBr2+H2
HgBr2+H2
③HgBr2+_____ _____ ④2HgO
_____ ④2HgO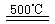 2Hg+O2↑
2Hg+O2↑
⑤2H2
+O2 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________________________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:__________________________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:反应①______________;反应②________________________。此法制取氢气的最大优点是_____________________________。
(4) 目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g) CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
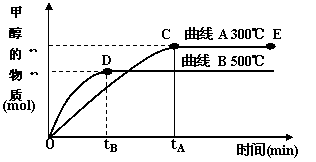
①合成甲醇反应,其反应热△H______0。(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的1/2,正反应速率加快,逆反应速率_________。(填“加快”、“减慢”、“不变”)重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)_______________________________________。
21、(10分)
某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为 。
(2)试剂1的化学式是 。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
;
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2: ;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
。
20、(12分)工业制硫酸生产流程如下图:
|
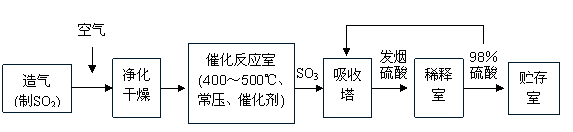

(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率采取了哪些措施?
A、净化气体 B、控制温度在400-500℃
C、增大催化剂与反应气体的接触面积 D、不断补充空气
(3)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(5)生产硫酸过程中的尾气通常用氨水吸收,请写出该反应的化学反应方程式 。
19、(12分)已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
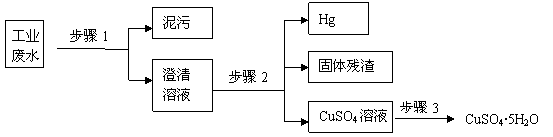
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
18、漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 = 4 ClO2↑+ H+ +Cl-+2H2O。( HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
A、在酸性条件下,亚氯酸钠的氧化性增强 B、溶液中的H+起催化作用
C、ClO2逸出,使反应的生成物浓度降低 D、溶液中的Cl-起催化作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com