
题目列表(包括答案和解析)
把电子层数目相同各种元素,按 排成横行;再 排成纵行得到一个表,这个表就叫元素周期表。元素周期表是 的具体表现形式,它反映了 相互联系的规律,是我们学习化学的重要工具。
1.周期:(1)周期序数=电子层数, 共
个周期( 、 、 短周期; 、 、 长周期; 不完全周期)。填表:
|
类别 |
周期序数 |
起止元素 |
包括元素种数 |
核外电子层数 |
|
短周期 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
长周期 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
不完全周期 |
|
|
|
|
(2) 总称镧系元素。 ,总称锕系元素。在锕系元素中 以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。
23..欲测定烟雾中的SO2含量,可做下列实验:取100L该空气(标准状况),通过盛放100mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65g。
(1)试写出SO2和H2O2反应的离子方程式。
(2)写出H2SO4与BaCl2反应的离子方程式。
(3)求100L空气中SO2的体积分数。
22.(9分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为_______(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 __________________________
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式_____________________________
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因__________________________________________________
21.(7分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中含的三种离子是___________、______________、______________。乙厂的废水中含有另三种离子。如果加一定量______________(选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属______________(填写金属元素符号)
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的___________(填写离子符号)转化为沉淀。经过滤后的废水主要含______________,可用来浇灌农田。
20.(6分)A、B、C是大家熟悉的且与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有如下转化关系:
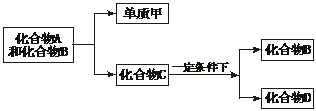
其中D也是日常生活中常见的有机化合物,在一定条件下可与单质甲进一步发生如下变化:D+3甲 3A+2B
3A+2B
试回答下列问题:
(1)在A、B、C、D四种化合物中,所含元素组成相同的是_______________(写物质名称)。
(2)常温下A和B是通过什么途径转化为C的?_______________,写出反应的化学方程式:____________________________。
(3)目前化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响。发生这种变化的主要原因是______________________________________。
19. (13分)氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
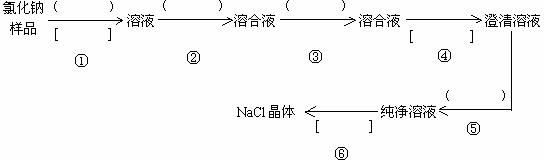
写出有关反应的化学方程式:
第步②
第步③
第步⑤
18、(8分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:① 取适量A进行铝热反应,产物中有单质B生成;② 另取20 g A全部溶于0.15 L 6.0 mol·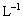 盐酸中,得溶液C;③ 将① 中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空:
盐酸中,得溶液C;③ 将① 中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空:
(1)① 中引发铝热反应的实验操作____ _____ ,产物中的单质B是______。
(2)② 中所发生的各反应的化学方程式是______________________
(3)③ 中所发生的各反应的离子方程式是___________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为____________,c(Fe2+)为__________。
17、下列有关污染的叙述,正确的是
A.酸雨主要是空气中的NO,经氧化与水反应生成HNO3所形成
B.破坏臭氧层的主要物质是氟氯烃等物质
C.温室效应主要是因空气中CO浓度增高造成的
D.发电厂排放大量的废热入河、海中,会使流径的水域溶氧量减少。
16.有一种粉末它是由铁的氧化物中的一种或者两种组成,取3.04 g粉末加热,同时通入足量的CO使之完全反应,再用过量澄清石灰水把生成气体充分吸收,产生沉淀 5 g。 则该粉末组成是
A.只有Fe2O3 B.只有FeO C.等物质的量的Fe2O3和Fe3O4 D.等物质的量的FeO和Fe3O4
15. 铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有
A.两性 B.良好导电性 C.熔点低 D.还原性,在反应中放出大量热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com