
题目列表(包括答案和解析)
3.已知氧化还原反应:( )
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到的电子为
A.10mol B.11mol C.12mol D.13mol
2.下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
A.100mL 0.5mol/L MgCl2溶液 B.200mL 0.25mol/L AlCl3溶液
C.50ml 1mol/L NaCl溶液 D.25ml 0.5mol/L HCl溶液
1. 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
A.1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B.Ca与H2O反应生成1.12L气体(标准状况),反应中转移的电子数为2×6.02×1023
C.32 g S8单质(结构如右图)中含有的S-S键个数为6.02×1023
D.22.4 L N2中所含的分子数为6.02×1023
27.(10分) (1)1S22S22P63S23P1(2分) (2)Na2Al2Si2O8(2分)
(3)1:2(1分),共价键(1分) (4)Si(2分)
(5)N2和O2的分子直径不同,直径小的分子通过分子筛,直径大的分子不能通过分子筛(2分)
26、(10分)(1)C5H10O(2分)
(2)
HOOC-CH2-COOH
+ 2C2H5OH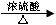 C2H5OOC-CH2-COOC2H5
+2H2O;(2分)
C2H5OOC-CH2-COOC2H5
+2H2O;(2分)
酯化反应(或取代反应)(1分)
(3)HO-CH2-CH2-CH=CH-CH3(2分)
(4)2;(1分)CH3CH2CH2COOH、CH3CH(CH3)COOH(2分)
24、(11分)
(1)HClO4(1分);第三周期第ⅦA族(1分)
(2)镁、铝(2分);Be(OH)2 (1分) ;Be(OH)2+2H+=Be2++2H2O(1分)
Be(OH)2+2OH-=BeO22-+2H2O(1分)
(3)强(1分);钠的原子半径大于镁,原子核对最外层电子的吸引力比镁弱,比镁原子更容易失去电子,所以钠元素的金属性比镁要强。(1分)
(4)(2分)
在两个小烧杯中分别加入等量蒸馏水,分别滴入几滴酚酞,然后投入形状大小相同的金属片,观察现象;或
在两个小烧杯中分别加入等体积等浓度的HCl,各投入形状大小相同的金属片,观察现象。(其它答案合理均给分)。
25(9分))⑴加成反应 (1分) 加聚反应(1分)
⑵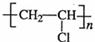 (1分) H2C=CH-CN(1分)
(1分) H2C=CH-CN(1分)
⑶HC≡CH+CH3COOH H2C=CH-OOCCH3(2分)
H2C=CH-OOCCH3(2分)
⑷ 4 (2分) CH2=CHCOOCH3 (1分) (合理即给分)
23.(10分)
(1)0.0020mol·L-1·s-1(2分)
(2)1.8mol·L-1(2分)
(3)变浅(1分)
(4)D(1分)AB(2分)
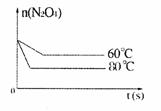 (5)(2分)
(5)(2分)
21、(10分)
(1) Fe3O4 + 8HCl==2FeCl3+FeCl2+4H2O(2分)
(2)KSCN(2分)
(3)2Fe2++Cl2=2Fe3++2Cl- (2分)
(4)①假设2:SCN-被过量的氯水氧化(2分)
②取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)
22 (13分) (1) B (2分)
(2) HgBr2+CaO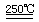 HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分)
HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分)
(3) ①:SO2+I2+2H2O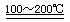 2HI+H2SO4(1分) ②:2H2SO4
2HI+H2SO4(1分) ②:2H2SO4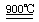 2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO
2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO Cu+CO2
(2分 不写可逆号扣1分)
Cu+CO2
(2分 不写可逆号扣1分)
20.(12分) (1)C、D(2分) (2)ABC(3分)
(3)① <(1分),在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热量小于196kJ (2分)(4)93.4% (2分)
(5)2NH3·H2O+SO3= (NH4)2SO4+ H2O(1分)2NH3·H2O+SO2=(NH4)2SO3 + H2O(1分)
19、(12分)(1)过滤(2分), 漏斗、玻璃棒(各1分,共2分)
(2)Cu(2分), Ag、Cu(各1分,共2分)
(3)冷却结晶(2分)(4)因为Hg有挥发性,且有毒。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com