
题目列表(包括答案和解析)
5.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,
其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法
不正确的是
A.青石棉是一种硅酸盐产品 B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1mol青石棉能使1molHNO3被还原
4.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
乙酸乙酯(乙酸) |
乙醇、浓硫酸 |
加热 |
3.实验室制备下列物质的方法合理可行的是
A、苯与浓溴水在铁粉作用下,以制取溴苯
B、食醋和无水酒精及浓硫酸共热,以制取乙酸乙酯
C、干馏煤可以得到甲烷、苯和氨等重要化工原料
D、无水乙醇与5 mol/L的硫酸共热至170℃,以制取乙烯
2.下列中学常见实验的现象或表述正确的是:
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.向饱和FeCl3溶液中滴入少量NaOH溶液,煮沸后即得红棕色Fe(OH)3胶体。
1.从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
A.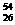 Fe与
Fe与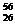 Fe互为同位素
Fe互为同位素
B.只由一种分子组成的物质一定为纯净物
C.质子数和电子数相等的某微粒,可能是一种分子
D.1mol Na2O2固体中阴、阳离子个数比为1:1
22. (6分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
_____Cr2O72-+_____Fe2++_____H+ --_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
⑴配平第②步中离子方程式。 ⑵计算工业甲醇的质量分数。
21.(10分)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个已配平的化学方程式,并用单线桥法标明电子转移情况:
(1) + -- + + +H2O;
(2)反应物中发生氧化反应的物质是 ,被还原的元素是 ;
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.2mol N2O气体,则转移电子的物质的量是 mol。
(5)请正确写出上述反应的离子方程式:
。
17.(6分)铁合金是金属材料王国的霸主,亚铁盐、铁盐、高铁酸盐等铁的重要化合物也在不同领域中个扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
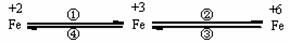
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+20 H+ ==4Fe3+ + 3O2 +10 H2O;
4FeO42-+10 H2O== 4Fe(OH)3 +3O2 +8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、金属锌片、惰性电极(或放电物质做电极)材料、蒸馏水及必要的实验仪器。
完成下列任务:
(1)设计一个实现上述转化①或者④的实验方案(要求产物纯净),写出简要的实验步骤。
(2)在浓碱中,用NaClO可以实现转化②,这一反应的离子方程式为: 。
(3)高铁酸盐是比高锰酸盐更强的氧化剂,研究证明它是一种“绿色环保高效”净水剂,比目前国内外广泛使用的含氯饮用水消毒剂(均为含氯的物质:如漂白粉、氯气和二氧化氯等,它们具有很好的杀菌效果,但不能将水中的悬浮杂质除去,为了除去水中的细微悬浮物,还需另外添加絮凝剂,如聚合铝的氯化物。)的性能更为优良,为什么说它作为净水剂是“绿色环保高效”的? .
18(12分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素.Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体.请回答下列问题:
(1).V单质分子的结构式为______________;XW的电子式为__________________;Z元素在周期表中的位置是_________.
(2).U元素形成的同素异形体的晶体类型可能是(填序号)________________.
①.原子晶体 ②.离子晶体 ③.分子晶体 ④.金属晶体
(3).U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明___________________________________.
(4).YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________.
由此可知VW和YW2还原性较强的是(写化学式)____________.
19(10分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+
Ba2+ Al3+ |
|
阴离子 |
OH-
Cl-
SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A , C ,D , E 。
⑵A溶液与过量E溶液反应后,最终得到沉淀的化学式是 。
20(9分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、
HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是_______________(填代号)

⑵根据上述实验判断原溶液中肯定存在的离子是___________________,
肯定不存在的离子是___________________
⑶写出与②③④三个实验有关的离子方程式:
②: ___ ___________ ___________ ________ ;
③: ___ ___________ _______ ____________ ;
④: ___ ___________ ___________ _______
15.(9分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。回答下列问题:
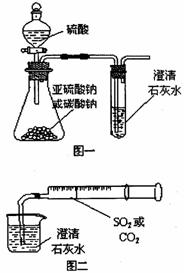 (1)写出实验中制取SO2的化学反应方程式:
(1)写出实验中制取SO2的化学反应方程式:
。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是
。
(3)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
。
(4)区别SO2和CO2气体可选用的试剂是 。
A.石蕊试液 B.KMnO 4溶液
C.品红溶液 D.酸化的Ba(NO3)2溶液
16(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.
(1).下列关于实验的叙述正确的有 .
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在玻璃棒搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2).下列实验没有错误的是 .
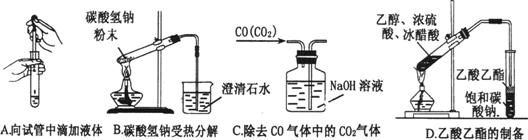
(3).下图为常见仪器的部分结构(有的仪器被放大)
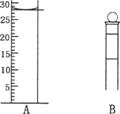

A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填字母标号).
14.下列离子方程式正确的是( )
A.氯气通入水中:Cl2+ H2O= 2H++ Cl-+ ClO-
B.Ba(OH)2溶液与MgSO4溶液混合:Ba2++ SO42-= BaSO4↓
C.向澄清的石灰水中加入足量NaHCO3溶液:Ca2++ 2OH-+ 2HCO3-= CaCO3↓+ CO32-+ 2H2O
D.苯酚钠溶液与少量的二氧化碳反应 C6H5O-+ CO2+ H2O=C6H5OH+HCO3-
第Ⅱ卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com