
题目列表(包括答案和解析)
4].催化剂能加快化学反应速率的原因是
A 能降低反应所需要的能量 B 加快分子运动的速率,增加分子碰撞的机会
C 催化剂并没有参与反应,所以能改变化学反应速率 D 以上说法均不对
3].对于反应N2+O2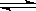 2NO在密闭容器中进行,下列条件中哪些能加快该反应的化学反应速率
2NO在密闭容器中进行,下列条件中哪些能加快该反应的化学反应速率
A 缩小体积使压强增大 B 体积不变充入氮气使压强增大
C 体积不变充入氦气使压强增大 D 使体积增大到原来的2倍
2].一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氨气和二氧化碳。对此反应,下列叙述中正确的是
A 使用催化剂不能改变反应速率 B 使用催化剂能改变反应速率
C 改变压强对反应速率没有影响 D 降低压强能加大反应速率
1].下列情况,反应速率不加快的是
A 在空气中燃着的木条插入盛有纯氧的瓶中 B 用煤粉代替煤块燃烧
C 锌粉和碘粉的混合物中滴入水 D 用0.01mol/L的盐酸代替1mol/L的盐酸与铁反应制取氢气
23、(08年四川理综·28)
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。

请回答下列问题。
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________,其方法是________________
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是
____________________。在这两步之间还应进行的操作是____________________________;
(4)反应过程中G管逸出的气体是________________,其处理方法是
______________________________________________________________________。
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
[答案](1)锌粒 水 浓硫酸 (2)检查气密性 将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好
(3)先从A瓶逐滴滴加液体 检验H2的纯度
(4)氢气
在G管出口处点燃 (5)

22、实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:____。
(2)硫酸溶液过稀会导致____。
(3)采用水浴加热的原因是____。
(4)反应时铁屑过量的目的是(用离子方程式表示)____。
(5)溶液趁热过滤的原因是___。塞紧试管口的目的是____。
(6)静置冷却一段时间后,在试管中观察到的现象是____。
1)Fe+H2SO4(稀) FeSO4+H2↑ (2)反应速率慢 不利于晶体析出
FeSO4+H2↑ (2)反应速率慢 不利于晶体析出
(3)(4)Fe3++2Fe=3Fe2+(5)减少FeSO4的损失 防止空气进入试管将Fe2+氧化为Fe3+
(6)有浅绿色晶体析出
21、实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 旋动。
(2)某学生用已知质量为 y g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作 ;
 (3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(4)过滤,某学生欲用右图装置操作,错误之处应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C的名称是 ;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
答案:(1)左;(2)往左盘表面皿上慢慢加少量样品,使指针指向标尺中间;
(3)氨水;(4)漏斗下端管口应紧靠烧杯内壁,倾倒液体时应用玻璃棒引流;
(5)Al(OH)3;(6)W1:(W-W1)或W1:133.5W2/78
20、某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理? (填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
(1)合理
(2)用磁铁吸引,若能吸附,说明有铁生成
(3)NaOH溶液 取少量样品放入试管,加入NaOH溶液, 有气泡产生,说明该熔融物中有铝。2Al+2NaOH+2H2O=2NaAlO2+3H2↑
19、A、B、C、D分别是HCl、FeCl3、MgCl2、AlCl3溶液中的一种,某实验小组用另一种溶液X与它们进行了如下图所示的实验:
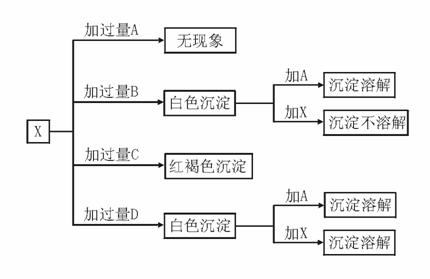
试推断A、B、C、D、X代表的物质(写化学式)。
A:____________B:____________C:____________D:____________X:____________
HCl MgCl2 FeCl3 AlCl3 NaOH(其他强碱亦可)
18、分液是实验室常见的基本操作之一。
(1)具有_________________的两种液体混合物可用分液的方法分离。
(2)某学生在一次分液操作中无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断依据:_________________。
答案:(1)密度不同且互不相溶
(2)轻微打开分液漏斗的活塞,放出少量下层液体于一支干净的小试管中,再向试管中加入少量水,若见到有分层现象,则分液漏斗中的下层液体是有机层,反之则是水层。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com