
题目列表(包括答案和解析)
6、金属性、非金属性变化规律
(1) 同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。金属性最强的位于左下角的铯,非金属性最强的是位于右上角的氟。
(2)金属性越强,单质越容易跟水或酸反应置换出氢,对应的最高价氧化物水化物碱性越强;非金属性越强,跟氢气反应越容易,生成的气态氢化物越稳定,对应的最高价氧化物水化物酸性越强。
5、分界线规律
位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
4、对角线规律
金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
3、化合价规律
(1) 同周期元素主要化合价:最高正价由+1→+7(稀有气体为0价)递变、最低负价由-4→-1递变。(2) 关系式:最高正化合价+|最低负化合价|=8; 最高正化合价=主族族序数=最外层电子数=主族价电子数。(3) 除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
2、数目规律
(1) 元素种类最多的是第IIIB族(32种)。 (2) 同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:第2、3周期(短周期)相差1;第4、5周期相差11;第6、7周期相差25。 (3)设n为周期序数,每一周期排布元素的数目为:奇数周期为 (n+1)2/2;偶数周期为(n+2)2/2。如第3周期为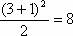 种,第4周期为
种,第4周期为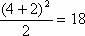 种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
1、最外层电子数规律
(1)最外层电子数为1的元素:方族(IA族)、副族(IB、VIII族部分等)。(2)最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB族)、0族(He)、VIII族(26Fe、27Co等)。 (3)最外层电子数在3~7之间的元素一定是主族元素。 (4)最外层电子数为8的元素:0族(He除外)。
1869年2月,俄国化学家门捷列夫将当时已发现的63种元素列成元素周期表,并留下一些空格,预示着这些元素的性质。在元素周期表的指导下,人们“按因索骥”找出了这些元素。
元素种类到底是否有限? 周期表有否终点? 这是科学家们,也是诸位读者所关心的问题。
本世纪30-40年代,人们发现了92号元素,就有人提出92号是否是周期表的最后一种元素。然后从1937年起,人们用人工合成法在近50年时间又合成近20种元素,元素周期尾巴越长了。这时又有人预言,105号元素该是周期表的尽头了,其理由是核电荷越来越大,核内质子数世越来越大,质子间的排斥力
将远远超过核子间作用力,导致它发生蜕变,然而不久,又陆续合成了106-109号元素。这些元素存在的时间很短,如107号元素半衰期只有2微秒,照此计算是否周期表到尽头了?
1969年起,理论物理学家从理论上探索“超重元素”存在的可能性,他们认为具有2,8,14,28,50,82,114,126,184等这些“幻数”的质子和中子,其原子核比较稳定,这就是说,随着原子序数的递增,其原子核不一定不稳定。因此在109号元素之后还能合成一大批元素,这样一来,第七周期32种元素将会被填满,第八周期也将填满(按理论计算,第八周期元素共50种,其中7种主族元素,1种惰性元素,10种过渡元素或副族元素,还有32种超锕系元素,列在周期表下方的锕系下方)。
然而理论的唯一检验标准是实践,能否不断合成新元素至今还是一个谜案,科学家将上天(如到月球)入地(如海底)或反复在粒子加速器中进行实验,企图合成新元素,其结果将会如何,人们正拭目以待。
有趣的是,有些科学家还提出元素周期表还可以向负方向发展,这是由于科学上发现了正电子、负质子(反质子),在其它星球上是否存在由这此些反质子和正电子以及中子组成的反原子呢?这种观点若有一朝被实践证实,周期表当然可以出现核电荷数为负数的反元素,向负向发展也就顺理成章了。
(二)卤族元素
1、卤素原子结构(1)示意图:F Cl Br I 。
最外层电子数相同,但电子层数逐渐增大,得电子能力 ,非金属性 。
2、卤族元素单质的物理性质的变化规律 (随原子序数的递增)
(1)颜色:__色-__色-___色-__色 (颜色逐渐加深 ) (2)状态: _态-_态-_态(3)熔沸点:逐渐__ (4)密度: 逐渐__ (5)水溶解性:逐渐__。
3、卤素单质与氢气反应
|
名称 |
反应条件 |
方程式 |
生成氢化物的稳定性 |
||||
|
F2 |
_____ |
H2+F2====2HF |
HF很稳定 |
||||
|
Cl2 |
_____ |
|
HCl稳定 |
||||
|
Br2 |
_____ |
H2+Br2======2HBr |
HBr较不稳定 |
||||
|
I2 |
_____ |
H2+I2======2HI |
HI___稳定 |
(4)随核电荷数的增加,卤素单质氧化性逐渐减弱:Cl2+_NaBr-______;氟气与氯化钠水溶液反应:____________。
疑难点拨
(一)碱金属元素
1、原子结构
|
|
元素名称 |
核电荷数 |
原子结构示意图 |
最外层电子数 |
电子层数 |
|
碱 金 属 元 素 |
|
|
 |
|
|
|
|
|
 |
|
|
|
|
|
|
 |
|
|
|
|
|
|
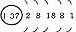 |
|
|
|
|
|
|
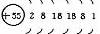 |
|
|
结构异同:异:核电荷数:由_→_;电子层数:由_→_;同:最外层电子数均为_个。单质密度逐渐 ,熔沸点逐渐 。
2、碱金属的化学性质:钾的保存及取用方法: 。
(1)与氧气反应差异性:
Li+O2 _(_色、氧化锂);_Na+O2
_(_色、氧化锂);_Na+O2 __(_色、过氧化钠);_K+O2
__(_色、过氧化钠);_K+O2 _(_色,_氧化钾);_Rb+_O2
_(_色,_氧化钾);_Rb+_O2 _(棕色、_氧化铷);_CS+_O2
_(棕色、_氧化铷);_CS+_O2 _(_色、_氧化铯)。
_(_色、_氧化铯)。
(2)与水反应差异性:(填反应现象)
2Li+2H2O=2LiOH+H2↑(__);2Na+2H2O=2NaOH+H2↑(剧烈);2K+2H2O=2KOH+H2↑(____、__);2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸)。
(3)写出下列反应的化学方程式:
过氧化钾与CO2: ;超氧化钾与水、CO2: 、 ;
氧化锂与水、CO2 : 、 。
2.族:(1)由 构成的族,叫做主族; 构成的族,叫做副族。(2)元素周期表的中部从 族到 族10个纵行,包括了 族和全部副族元素,共六十多种元素,通称为过渡元素。因为这些元素都是 ,所以又把它们叫做过渡金属。(3)主族元素的族序数=元素原子的最外层电子数。周期表共18个纵行( 个主族; 个副族;一个 族;一个 族( 、 、 三个纵行))。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com