
题目列表(包括答案和解析)
33].下列各图中,表示正反应是吸热反应的是
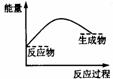
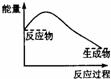
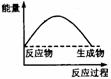

A B C D
32].对于一个化学反应,下列说法正确的是(注:ΔHy表示等压条件下的化学反应的热效应,ΔHy<0,放热;ΔHy>0,吸热。
A ΔHy越负,其反应速率越快 B ΔHy越正,其反应速率越快
C 只要有催化剂,那么反应肯定加速 D 以上三种说法都不正确
31].在化工生产中,如果要加快反应速率,应该优先考虑的科研方向是
A 提高设备强度,以便加压 B 选择适宜的催化剂
C 采用高温 D 用块状反应物代替粉末状反应物
28].某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右,于是对A和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已忽略)。
表一 用MnO2作催化剂
|
实验序号 |
KClO3质量(g) |
MnO2质量(g) |
反应温度(℃) |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
表2 用A作催化剂
|
实验序号 |
KClO3质量(g) |
A质量(g) |
反应温度(℃) |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
请回答:
上述实验中的待测数据应是: 。
完成此研容后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目: 。
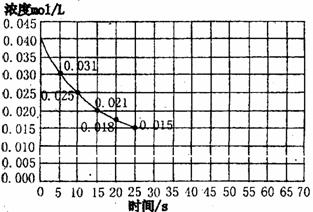 [29].二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡(NO2浓度约为0.0125mo/L)图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
[29].二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡(NO2浓度约为0.0125mo/L)图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
(1)请计算前20s内氧气的平均生成速率 。
(2)若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加入催化剂后的反应进行曲线。
(4)达到平衡时NO2的分解率为 。
(5)已知氮的氧化物跟NaOH溶液发生的化学反应如下
2NO2+2NaOH=NaNO3+NaNO2+H2O NO2+NO+2NaOH=2NaNO2+H2O
所以实验室常用氢氧化钠溶液来吸收氮的氧化物。但在生产中却经常使用较烧碱价廉的纯碱溶液吸收氮的氧化物,纯碱溶液同样可与NO、NO2发生类似上述的反应,并将氮氧化物刚好吸收完,试写出纯碱溶液吸收NO和NO2的两个反应的化学方程式: ; 。
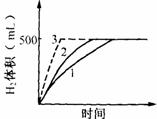 [30].某高一化学课外活动小组进行下列实验。
[30].某高一化学课外活动小组进行下列实验。
实验1:将0.5g金属X放入装有80mL 1mol/L盐酸的烧瓶中,产生H2的体积(室温下)与时间的关系如右图曲线1所示。
实验2:另取同样的0.5g金属X与50 mL 2mol/L盐酸反应,产生H2的体积(室温下)与时间的关系见右图的曲线2。已知金属X是第ⅡA族元素。
根据这些信息回答下列问题:
(1)判断在实验1中,X与盐酸哪种物质过量,你的根据是什么?
(2)计算X的相对原子质量(室温下,任何气体的摩尔体积为24.4L/mol)。
(3)请画出制取H2并能测量H2体积的装置图。
(4)若用0.5g金属X与50mL 2mol/L盐酸反应,要获得曲线3,请说出两种不同的方法。
B组
24].A(气)+B(气)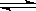 C(气)的平均反应速率为0.001mol/(L·s),温度每升高10℃,反应速率增大到原来的3倍。当温度升高了50℃,在此条件下反应进行10s后,物质C的浓度为
。
C(气)的平均反应速率为0.001mol/(L·s),温度每升高10℃,反应速率增大到原来的3倍。当温度升高了50℃,在此条件下反应进行10s后,物质C的浓度为
。
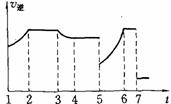 [25].右图为反应A(s)+D(g)
[25].右图为反应A(s)+D(g)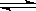 E(g)+Q的逆反应速率随时间的变化情形,试根据此曲线填写下表。
E(g)+Q的逆反应速率随时间的变化情形,试根据此曲线填写下表。
|
时刻 |
时间 |
可能采取的措施 |
体系中平衡移动的方向 |
|
3 |
- |
|
- |
|
- |
3-4 |
- |
|
|
5 |
- |
|
- |
|
- |
5-6 |
- |
|
|
7 |
- |
|
- |
 [26].把除去氧化膜的镁条投入到稀盐酸的试管中,发现氢气发生的速率变化情况如右图所示。其中t1-t2速率变化的主要原因是
,t2-t3速率变化的主要原因是
。
[26].把除去氧化膜的镁条投入到稀盐酸的试管中,发现氢气发生的速率变化情况如右图所示。其中t1-t2速率变化的主要原因是
,t2-t3速率变化的主要原因是
。
 [27].氯酸钾和亚硫酸氢钠发生氧化一还原反应生成Cl(-1价)和S(+6价)的反应速率如右图所示,已知这个反应的速率随着溶液的[H+]增大而加快,则:
[27].氯酸钾和亚硫酸氢钠发生氧化一还原反应生成Cl(-1价)和S(+6价)的反应速率如右图所示,已知这个反应的速率随着溶液的[H+]增大而加快,则:
(1)反应开始时,速率加快的原因为
(2)后期反应速率下降的原因为
23].下列反应中“加入物质”能起催化作用的是
A 在H2O2分解反应中,“加入MnO2”后反应速率加快
B 在锌粒与稀硫酸反应中,“加入几滴硫酸铜溶液”后,产生氢气的速率加快
C 醋酸钠在水溶液中水解缓慢,“加入几滴盐酸”后,水解速率加快
D 苯的硝化反应中“加入浓硫酸”后,反应速率加快
E 实验室电解水时,“加入少量氢氧化钠溶液”后,产生气体的速率加快
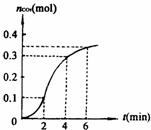
19].碳酸钙与稀盐酸反应(放热反应)生成的CO2的量与反应时间的关系如右图所示。下列结论中不正确的是
A 反应开始2min内平均反应速率最大
B 反应4min后平均反应速率最小
C 反应开始4min内温度对反应速率的影响比浓度大
D 反应在第2min到第4min间生成CO2的平均反应速率为v(CO2)=0.1mol·min-1
 [20].某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是
[20].某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是
A OA段表示开始时,反应速率稍慢
B AB段表示反应速率较快,可能因为产物有催化作用
C BC段表示反应速率最快,在该时间内收集到的气体最多
D OC线表示随时间增加,反应速率逐渐增大
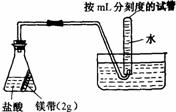 [21].用右图所示的实验装置进行实验X及Y时,每隔半min分别测定放出气体的体积。下图中正确表示实验X及Y的结果的是
[21].用右图所示的实验装置进行实验X及Y时,每隔半min分别测定放出气体的体积。下图中正确表示实验X及Y的结果的是
|
实验 |
所用的酸 |
|
X |
25mL
0.2mol/L |
|
Y |
50mL
0.1mol/L |
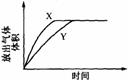


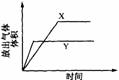
A B C D
 [22].一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是
[22].一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是
A 投入的Na、K物质的量一定相等 B 曲线a对应的反应使用了催化剂
C 曲线a代表K的反应,曲线b代表Na D 两反应中盐酸必须是足量的
18].进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL 1mol/L盐酸,下图中能正确表示实验结果的是(注:x一时间、y-锥形瓶中碳酸钙减少的质量)
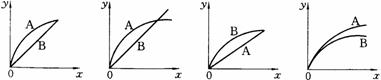
A B C D
17].将Ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将Bg粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
A.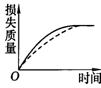 B.
B.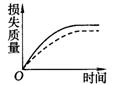 C.
C. D.
D.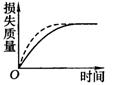
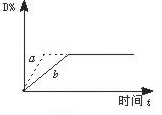
15].右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
A 升高温度 B 加大X的投入量
C 加催化剂 D 增大体积
 [16].已知反应3A(g)+B(g)
[16].已知反应3A(g)+B(g) C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是
①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂
C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是
①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂
A ①② B ①③ C ②③ D ③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com